Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.

Perhatikan reaksi berikut.NH3 + H2O NH4+ + OHMenurut konsep BronstedLowry, yang bertindak
Dalam kimia, spesi adalah suatu jenis zat atau molekul yang memiliki sifat-sifat khas. Ada berbagai jenis spesi dalam kimia, di antaranya ion, radikal, senyawa kompleks, dan molekul. Spesi sangat penting dalam kimia karena memberikan informasi tentang sifat-sifat kimia dari suatu zat atau molekul. Spesi juga digunakan dalam berbagai aplikasi.

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Teori Asam Basa Menurut Bronsted-Lowry merupakan konsep penting dalam kimia yang menjelaskan bagaimana reaksi asam-basa terjadi. Menurut teori ini, asam adalah zat yang mampu melepaskan ion hidrogen (H+), sedangkan basa adalah zat yang mampu menerima ion hidrogen. Teori Bronsted-Lowry memungkinkan kita untuk memahami reaksi asam-basa yang.

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
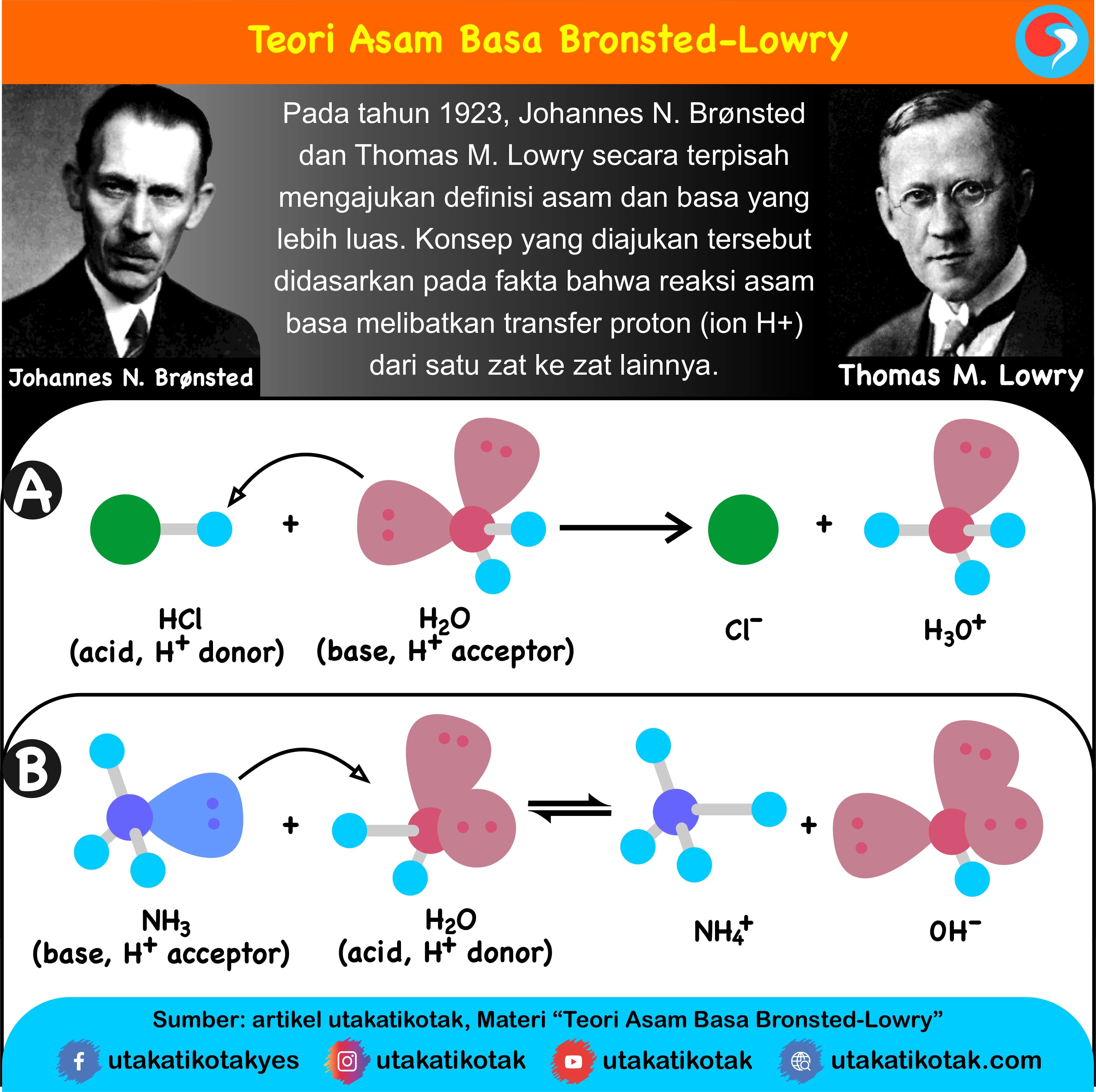
Pada tahun 1923 Johannes N. Bronsted dan Thomas M. Lowry mengajukan konsep asam basa berdasarkan pemindahan proton (H +) Berikut ini asam basa menurut Bronsted-Lowry: Asam adalah spesi yang dapat memberikan proton atau donor proton (H +) Basa adalah spesi yang dapat menerima proton atau akseptor proton (OH -) Contoh : NH 3 + H 2 O ↔ NH 4.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
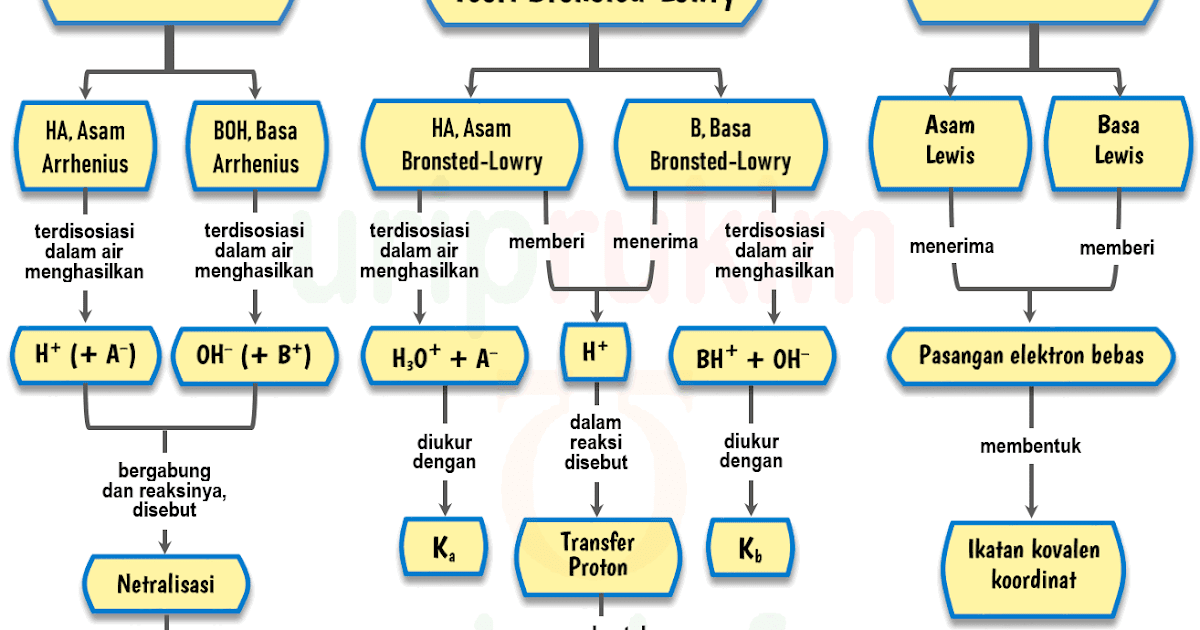
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Teori Asam Basa Bronsted-Lowry dikemukakan oleh Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923. Teori ini dapat menjawab kekurangan yang terdapat pada teori Arhennius. Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry.

Sintético 104+ Foto Acidos Y Bases De Bronsted Lowry Lleno
Beberapa ilmuwan yang mengembangkan teori asam basa yaitu Arrhenius, Bronsted-Lowry, dan Lewis. Teori Asam Basa Lewis Pada tahun 1932 G. N. Lewis, seorang ahli kimia dari Amerika mengartikan asam sebagai suatu zat yang dapat menerima sepasang elektron, dan basa adalah zat yang dapat memberikan sepasang elektron.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).
Teori Asam Basa Bronsted Lowry Dalam ilmu Kimia
Untuk mendefinisikan suatu zat apakah bersifat asam atau basa menurut teori Brønsted-Lowry, yang perlu diperhatikan adalah proses transfer (perpindahan) ion H+ (proton) yang terjadi antar zat dalam suatu persamaan reaksi. Persamaan reaksi yang melibatkan tranfer proton inilah yang disebut dengan reaksi asam-basa menurut teori Brønsted-Lowry.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Perhatikan reaksi berikut. NH3+H2O NH4^(+)+OH^() Menur...
Amonia (NH3) Amonia (NH3) juga merupakan contoh spesi kimia yang bersifat basa menurut konsep Bronsted-Lowry. Amonia dapat menerima proton dari asam sehingga membentuk ion amonium (NH4+). Contohnya, ketika amonia bereaksi dengan asam klorida (HCl), maka akan terjadi reaksi sebagai berikut: HCl + NH3 → NH4+ + Cl- Dalam hal ini, amonia berperan.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Spesi kimia. Suatu spesi kimia adalah suatu zat kimia atau ansambel yang terdiri dari entitas molekuler yang identik secara kimiawi yang dapat mengeksplorasi rangkaian tingkat energi molekul yang sama pada skala karakteristik atau waktu yang digambarkan. Istilah ini diterapkan secara sama pada seperangkat unit struktur atom atau molekul yang.

Teori Asam Basa Bronsted Lowry YouTube
d. Spesi basa dapat meningkatkan konsentrasi ion OH- dalam larutan. e. Basa merupakan sifat dari senyawa yang menerima proton. Jawab: e. Basa merupakan sifat dari senyawa yang menerima proton. Pembahasan: Menurut Bronsted-Lowry, asam dan basa didefinisikan sebagai berikut: 1. Asam adalah senyawa yang akan mendonorkan proton. 2. Basa adalah.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Menurut teori asam-basa Bronsted-Lowry, asam merupakan donor proton (H +) sehingga harus memiliki atom H, sedangkan basa merupakan aseptor / penerima proton (H +) sehingga harus memiliki pasangan elektron bebas.. Pada keempat spesi diatas, yang tidak dapat bertindak sebagai asam dan basa adalah O 2 − karena tidak memiliki atom H sehingga tidak dapat bertindak sebagai asam dan hanya dapat.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
CH3COOH dan NO2-. Pembahasan : Menurut Bronsted Lowry : Asam adalah spesi yang memberi proton (H+). Basa adalah spesi yang menerima proton (H+) Pada reaksi : CH3COOH + HNO2 <==> CH3COOH2+ + NO2- Berdasarkan konsep asam basa Bronsted Lowry : # pasangan CH3COOH dan CH3COOH2+ Merupakan pasangan basa-asam konjugasi.

Kimia Sma Asam Basa Bronsted Lowry Menentukan Asam Atau Basa Suatu Sexiz Pix
Sama seperti teori asam basa yang dikemukakan oleh Arrhenius, teori asam basa menurut Bronsted Lowry juga memiliki kelebihan dan kekurangan tersendiri. Teori ini memiliki kelebihan dalam hal cangkupannya yang lebih luar di mana tidak terbatas pada senyawa yang dilarutkan dalam air saja, tapi juga dapat menjelaskan reaksi asam basa dalam pelarut.