
Contoh Perubahan Entalpi Pembentukan Sketsa
Pengertian Entalpi Pembentukan Standar Entalpi pembentukan standar Hf suatu senyawa adalah perubahan entalpi yang menyertai pembentukan satu mol molekul dari unsur-unsurnya dengan semua zat pada keadaan standar. Entalpi pembentukan standar mempunyai simbol ∆Hfo. Superskrip nol pada fungsi termodinamik mengindikasikan adanya proses yang berlangsung pada keadaan standar. Penjelasan Entalpi.

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Entalpi pembentukan adalah perubahan jumlah kalor pembentukan per 1 mol suatu senyawa dari unsur-unsurnya pada kondisi normal. Nilai normal standar ditentukan pada suhu 298 oK dan tekanan 100 kPa. Dalam unsur bebas, entalpi pembentukan standar adalah nol. Entalpi pembentukan dalam kondisi standar dilambangkan Δ𝐻𝑓𝑜.

Entalpi Penguraian Standar (Jenisjenis Entalpi) YouTube
Entalpi pembentukan adalah perubahan sejumlah panas dari pembentukan tiap 1 mol suatu senyawa dari unsur-unsurnya pada keadaan normal. Standar nilai normal ditentukan pada suhu 298 o K dan tekanan 100 kPa. Pada unsur bebas, entalpi pembentukan memiliki standar bernilai nol. Entalpi pembentukan pada kondisi standar disimbolkan dengan Δ𝐻 𝑓.

Perubahan Entalpi Penguraian Standar Dan Contohnya Amat
Panas pembentukan adalah perubahan entalpi yang terjadi ketika zat murni terbentuk dari unsur-unsurnya dalam kondisi tekanan konstan. Ini adalah contoh soal yang dikerjakan menghitung kalor pembentukan. Tinjauan. Simbol untuk panas pembentukan standar (juga dikenal sebagai entalpi pembentukan standar) adalah H f atau H f ° di mana:

Perubahan Entalpi Pembentukan Standar dalam Reaksi Kimia
Berikut ini pernyataan yang tepat mengenai entalpi pembentukan standar adalah. . 1. Senyawa yang dibentuk harus berjumlah 1 mol. 2. Unsur-unsur pembentuk senyawa harus berjumlah 1 mol. 3. Reaksi pembentukan harus pada suhu ruang. 4. Unsur-unsur pembentuk senyawa harus berwujud gas.

Diketahui perubahan entalpi pembentukan standar delra Hf...
Perubahan entalpi standar dapat dibedakan menjadi 3, yaitu : Jenis perubahan entalpi standar Perubahan entalpi pembentukan standar ( ΔH f o) kalor yang dibutuhkan atau dilepas pada peristiwa pembentukan 1 mol senyawa dari unsur-unsur pembentukannya. Contoh : 1/2 N2(g) + 1/2 O 2 (g) -> NO(g) ΔH f o + ΔH f o = +90 kJ/mol

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Panas pembentukan, disebut juga entalpi pembentukan atau entalpi pembentukan standar, adalah jumlah panas yang terkait dengan proses pembentukan 1 mol suatu zat kimia dari unsur-unsur penyusunnya ketika berada dalam keadaan standarnya, yaitu, dalam bentuk alaminya yang paling stabil pada suhu 25 °C. Dalam hal ini, panas pembentukan mewakili.

Jenisjenis Perubahan Entalpi Standar YouTube
Perubahan entalpi pembentukan standar dapat terjadi secara eksoterm maupun endoterm. Untuk entalpi pembentukan standar dari unsur adalah '0'. Contoh soal, Tulislah reaksi pembentukan Fe2O3 jika diketahui entalpi pembentukan standarnya adalah -824 kJ/mol. Fe2O3 dibuat dari Fe(s) dan O2(g) maka reaksi pembentukan Fe2O3 dapat ditulis sebagai.

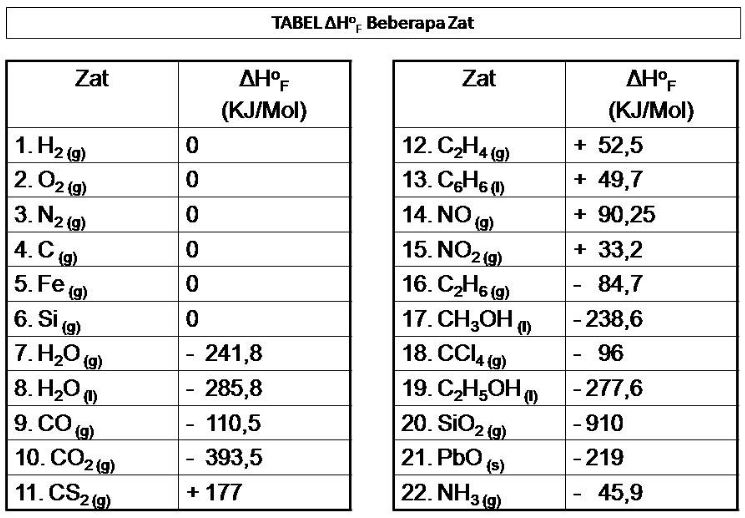
Berikut data perubahan entalpi pembentukan/standar bebera...
Entalpi pembentukan standar diberi simbol. Dengan mengetahui ΔH f (perubahan entalpi pembentukan) dari reaktan dan produknya, dapat diramalkan perubahan entalpi reaksi apapun, dengan rumus.. Walaupun energi ikatan adalah untuk molekul dalam fase gas, tetapi harga kira-kira panas reaksi dapat dihitung dari fase terkondensasi dapat.
Rumus Perubahan Entalpi Pembentukan Standar Materi Kimia
Hitunglah perubahan entalpi suatu reaksi dengan menggunakan nilai kalor pembentukan reaktan dan produk. Entalpi suatu unsur dalam keadaan standarnya adalah nol. Namun, alotrop unsur yang tidak dalam keadaan standar biasanya memiliki nilai entalpi.Misalnya, nilai entalpi O2 adalah nol, tetapi ada nilai untuk oksigen singlet dan ozon. Nilai entalpi aluminium padat, berilium, emas, dan tembaga.

MENGHITUNG PERUBAHAN ENTALPI MENGGUNAKAN DATA PERUBAHAN ENTALPI PEMBENTUKAN STANDAR (TERMOKIMIA
Perubahan entalpi pembentukan standar adalah perubahan entalpi yang berupa energi diterima atau energi yang dilepas untuk melakukan pembentukan 1 mol zat dari unsur-unsurnya yang paling stabil pada keadaan standar. Perubahan entalpi pembentukan standar secara matematis dirumuskan sebagai berikut: Satuan entalpi pembentukan standar adalah kilojoule per mol (kJ/mol).

Trik Menghitung Perubahan Entalpi Reaksi Berdasarkan Hukum Hess ilmu kimia
Perubahan entalpi pembentukan standar adalah pengukuran besarnya energi yang diserap atau dilepas untuk pembentukan 1 mol senyawa dari unsur-unsunya yang paling stabil pada keadaan standar. Contoh Persamaan termokimia dari reaksi pembentukan 1 mol NaCl yang membebaskan energi sebesar 77 kJ/mol adalah sebagai berikut.

Menghitung Entalpi Pembakaran Standar Berdasarkan Data Entalpi Pembentukan Standar (UN Kimia No
Entalpi Pembentukan Standar ( ΔH ∘ f) Perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 K, 1 atm). Sebagai contoh entalpi pembentukan standar untuk air adalah − 285 kJ/mol, maka persamaan termokimianya adalah sbb: H2(g) + 1 2O2 → H2O(l) ΔH = − 285 kJ. Yang perlu diperhatikan.

Perubahan Entalpi Pembakaran Standar Adalah Penggambar
Perubahan entalpi pembentukan standar atau pembentukan panas standar dari sebuah senyawa adalah besarnya perubahan entalpi dari 1 mol senyawa dari elemen-elemennya dalam keadaan standar.Lambangnya adalah ΔH f θ atau Δ f H θ.Lambang theta superskrip pada simbol di atas mengindikasikan bahwa proses ini hanya berlaku hanya pada kondisi standar saja. Kondisi yang dimaksud antara lain:

Contoh Perubahan Entalpi Pembentukan Sketsa
Gambar PM, Gambar Getty. Untuk memahami entalpi pembentukan standar O2 Sama dengan Nol, Anda perlu memahami definisi entalpi pembentukan standar . Ini adalah perubahan entalpi ketika satu mol zat dalam keadaan standar terbentuk dari unsur-unsurnya di bawah kondisi keadaan standar tekanan 1 atmosfer dan suhu 298K. Gas oksigen terdiri dari unsur.

Entalpi pembentukan NH4Cl adalah 314 kJ/mol. Persamaan r...
Misalnya, katakan kita akan mencari entalpi reaksi untuk pembentukan air dari hidrogen dan oksigen: 2H 2 (Hydrogen) + O 2 (Oxygen) → 2H 2 O (Water). Dalam persamaan ini, H2 dan O2 adalah reaktan dan H2O adalah produk. Tentukan massa total reaktan. Selanjutnya, carilah massa reaktanmu.