
Tekanan gas dalam ruang tertutup(1) sebanding dengan kece...
Ada pula rumus dari tekanan zat gas ialah sebagai berikut: Tekanan udara= 76 cmHg - (ketinggian/ 100 meter) atau Tekanan udara= 760 mmHg - (ketinggian/ 10 meter) Sementara itu, gas yang ada pada ruang tertutup akan berlaku pada Hukum Boyle. Tekanan serta volume gas dalam ruang tertutup ialah konstan selama suhu gas menetap atau tidak berubah.

Tekanan gas dalam ruang tertutup 1) Sebanding dengan ke...
Volume gas dalam suatu ruang tertutup sangat bergantung pada tekanan dan suhunya. Bila suhu dijaga konstan, maka tekanan yang diberikan akan memperkecil volume. Bunyi hukum Boyle sebagai berikut: "Apabila suhu gas yang ada di dalam ruang tertutup dijaga konstan, maka tekanan gas berbanding terbalik dengan volumenya". Dapat ditulis dengan rumus:

Rumus Tekanan Gas Dalam Ruang Tertutup Foto Modis
P₁ = Tekanan mula-mula gas dalam ruang (Nm² atau Pa) V₁ = Volume mula-mula gas dalam ruang (m3) P₂ = Tekanan akhir dalam ruang (Nm² atau Pa) V₂ = Volume akhir dalam ruang (m3) Perlu diketahui ya Grameds, untuk mengukur tekanan gas yang ada di ruang tertutup itu dapat menggunakan alat bernama manometer. Berikut adalah bentuk dari.

Suatu gas ideal monoatomik yang berada di dalam ruang ter...
v: volume ruang. n: jumlah mol gas. R: tetapan umum gas. T: suhu (Kelvin) Perhatikan satuan: R= 8314 J/kmol K apabila tekanan dalam Pa atau N/m 2, volume dalam m 3, dan jumlah mol dalam kmol. R= 0,082 L atm/mol K apabila tekanan dalam atm, volume dalam liter, dan jumlah mol dalam mol.

Suatu gas ideal berada dalam ruang tertutup dengan volume 5 liter, tekanan 2 atm dan suhu 870C
2. Tekanan Gas Dalam Ruang Tertutup Partikel-partikel gas akan senantiasa bergerak. Partikel-partikel gas didalam sebuah ruangan yang tertutup akan memberikan tekanan pada dinding ruang. Misalnya, suatu gas yang mengandung sejumlah partikel berada dalam suatu ruang yang berbentuk kubus dengan sisi L dan luas masing-masing sisinya A . 3.

Tekanan Gas Dalam Ruang Tertutup PDF
P 1 = tekanan udara awal. V 1 = volume udara awal. P 2 = tekanan udara akhir. V 2 = volume udara akhir. Kamu pasti masih bingung dan membayangkan 'seperti apa ya tekanan udara dalam ruang tertutup di kehidupan sehari-hari'? Nah, berikut ini ada beberapa fenomena tekanan udara dalam ruang tertutup yang bisa kita temui. Simak ya.

Rumus Gas Ideal Riset
Inilah contoh penerapan konsep tekanan zat dalam kehidupan sehari-hari. Dalam Kamus Besar Bahasa Indonesia, tekanan adalah keadaan yang berasal dari kekuatan menekan.. Rumus tekanan gas pada ruang tertutup adalah sebagai berikut: Untuk gas campuran: Tekanan pada gas sering dinyatakan dengan satuan atmosfer (atm) sebagai berikut:

Gas berada dalam ruang tertutup dengan volume V, tekanan P dan suhu T. Apabila volumenya menjadi
Tekanan Gas Ideal. Keberadaan gas di ruang tertutup bisa mengakibatkan adanya tekanan. Tekanan tersebut disebabkan oleh adanya tumbukan antara partikel gas dan dinding tempat gas berada. Besarnya tekanan gas di ruang tertutup dirumuskan sebagai berikut. Keterangan: P = tekanan gas (N/m 2); V = volume gas (m 3); m = massa partikel gas (kg);

Menurut Teori Gas Tekanan Gas Dalam Ruangan Tertutup Adalah World of Nirmala
Bunyi hukum Boyle yaitu, pada suhu tetap tekanan gas di dalam ruang tertutup berbanding terbalik dengan volumenya. Rumus Hukum Boyle. Rumus hukum Boyle adalah hasil kali tekanan gas dan volume di ruang tertutup pada suhu konstan adalah tetap. Dari rumus tersebut kemudian dilakukan persamaan yaitu: P 1 x V 1 = P 2 x V 2 . Keterangan:

Gas dalam ruang tertutup mempunyai tekanan 1 ATM. jika kemudian gas tersebut di tekan pada suhu
Adapun rumusnya sebagai berikut: Tekanan Udara = 76 cmHg - (Ketinggian/100 meter) atau. Tekanan Udara = 760 mmHg - (Ketinggian/10 meter) Sementara itu, gas yang berada pada ruang tertutup akan berlaku Hukum Boyle. Tekanan dan volume gas dalam ruang tertutup adalah konstan selama suhu gas tetap.

Rumus Dan Soal Pembahasan Tekanan Gas Ruang Tertutup √ Lengkap Pengertian, Hukum, Rumus
Tekanan Pada Gas Dalam Ruang Tertutup. Ilustrasi yang akan mudah membantumu memahami materi ini adalah tekanan pada balon gas yang telah diisi udara, kemudian perlahan-lahan kita buat beberapa lubang pada balon tersebut. Setelah itu, kita tekan balon dan rasakan tekanan gas yang keluar dari masing-masing lubang.
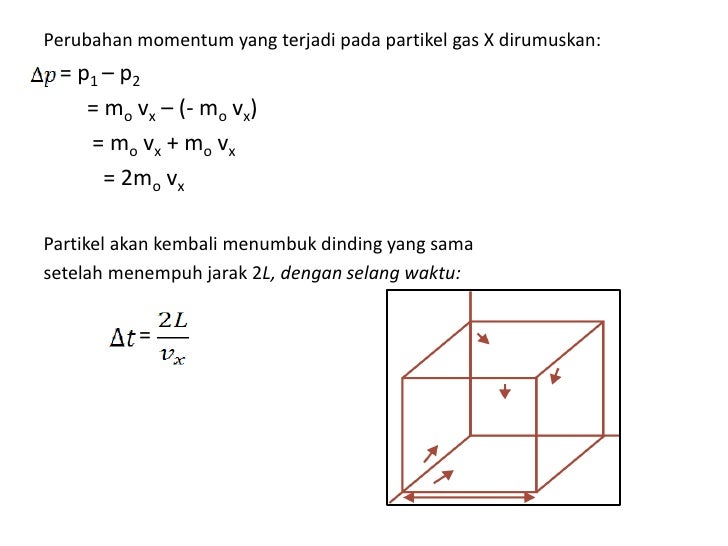
Tekanan gas dalam ruang tertutup
Hasil dari tekanan dan volume gas dalam ruang tertutup selalu tetap, yang penting suhu gas gak berubah - ubah. Dari pernyataan tersebut, yang sekarang dikenal dengan Hukum Boyle. Nah, hukum boyle ini bisa ditulis dalam rumus seperti berikut ini:. Rumus Tekanan Zat Gas. Nah, buat menghitung suatu tekanan zat gas pada ketinggian tertentu.

Rumus Tekanan Gas Dalam Ruang Tertutup Foto Modis
Pernyataan Robert Boyle dikenal dengan Hukum Boyle, yang berbunyi : "Pada suhu tetap, tekanan gas di dalam ruang tertutup berbanding terbalik dengan volumenya". Dari hukum Boyle tersebut berarti hasil kali tekanan dan volume gas dalam ruang tertutup adalah konstan (tetap) asalkan suhu gas tetap. Pernyataan tersebut bila ditulis dalam bentuk.

Rumus Tekanan Gas Dalam Ruang Tertutup Foto Modis
Simbol dan Satuan Tekanan Dalam fisika, besaran tekanan disimbolkan atau dilambangkan dengan huruf P atau p. Satuan tekanan menurut Sistem Satuan Internasional. Rumus tekanan gas pada ruang tertutup adalah sebagai berikut: p . V = konstan. p 1. V 1 = p 2 . V 2. Untuk gas campuran: p campuran = (p 1. V 1) - (p 2 .

Rumus Tekanan Gas Dalam Ruang Tertutup Foto Modis
Pertanyaan. Tekanan gas ideal di dalam ruang tertutup terhadap dinding tabung dirumuskan sebagai P = 32 V N E k , dengan P = tekanan, N = jumlah partikel, V = volume gas, dan EK = energi kinetik rata-rata molekul. Berdasarkan persamaan tersebut, pernyataan yang benar adalah. Tekanan gas terhadap dinding bergantung pada energi kinetik rata.
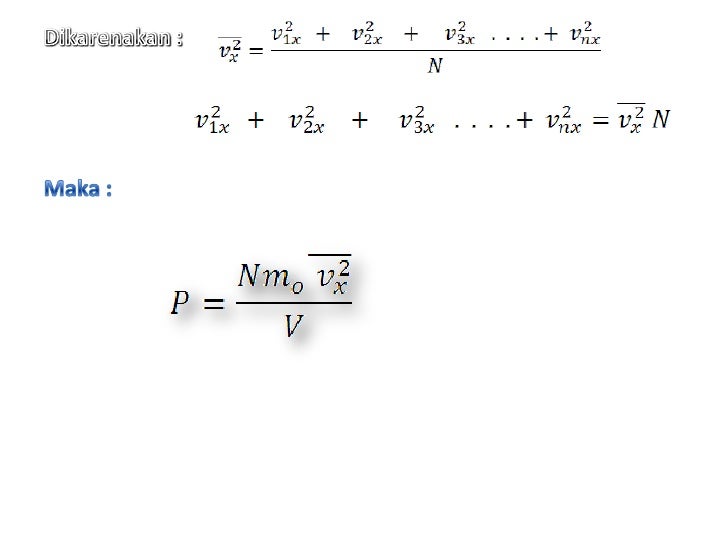
Rumus Tekanan Gas Dalam Ruang Tertutup Foto Modis
Pembahasan. Tekanan gas dalam ruang tertutup dirumuskan sebagai: Sehingga, kesimpulan yang diperoleh bahwa tekanan: (1) Sebanding dengan kecepatan rata-rata partikel gas. (2) Sebanding dengan energi kinetik rata-rata partikel gas. (3) Berbanding terbalik dengan volume gas. (4) Bergantung pada banyaknya partikel gas.