
Faraday's law of electrolysis First and Second law Chemistry Notes
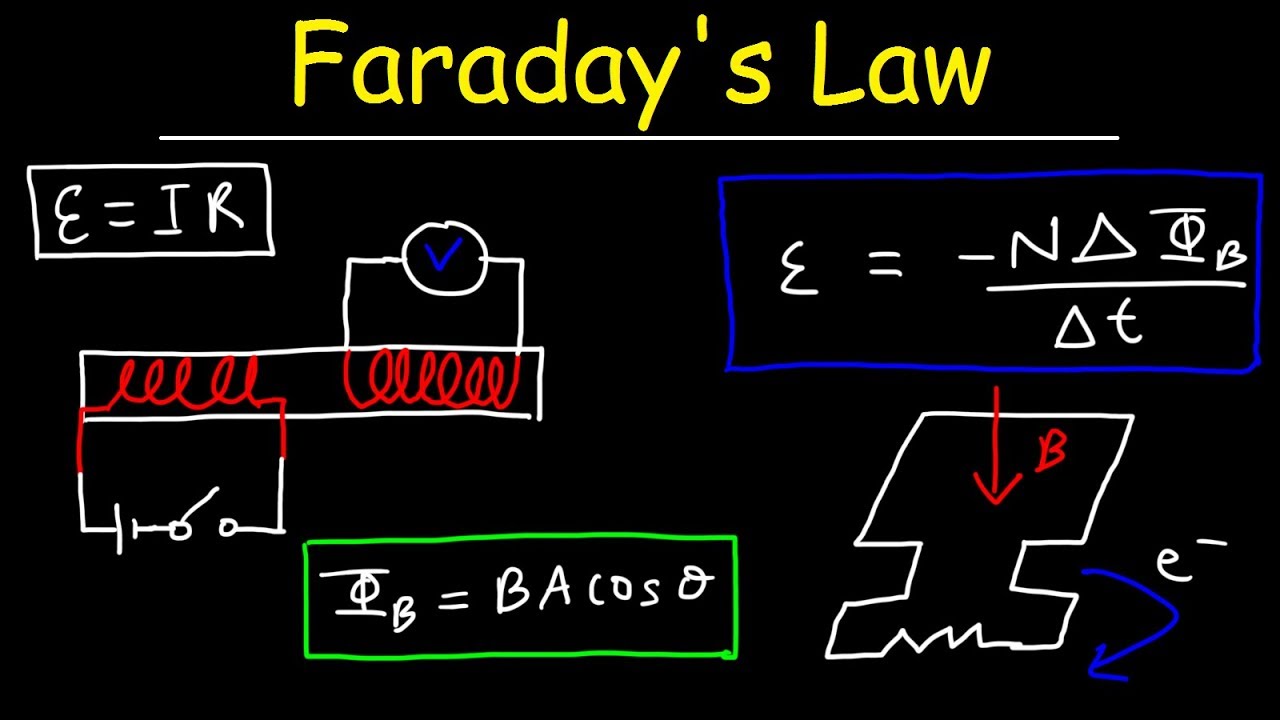
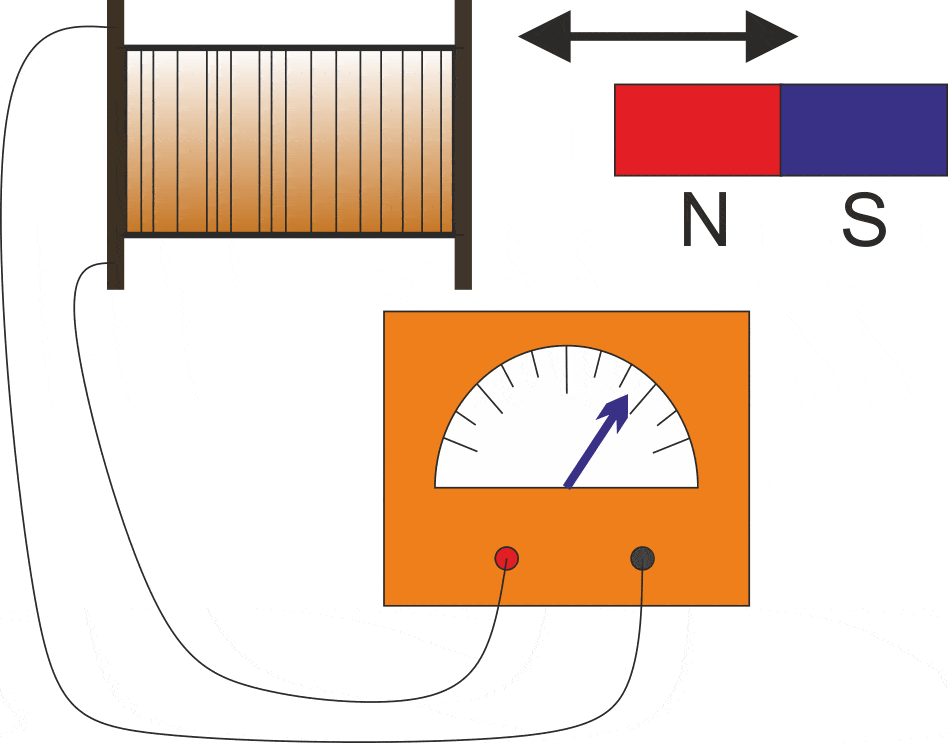
Rumus Hukum Faraday untuk menghitung suatu gaya gerak listrik maka, rumus yang digunakan secara sistematis ialah sebagai berikut: ɛ = -N (ΔΦ / ∆t) Keterangan: ɛ ialah gaya gerak listrik (ggl) induksi (volt) N ialah jumlah lilitan kumparan. ΔΦ ialah perubahan gaya medan magnet atau fluks magnetiks (weber)
faraday law of induction
Faraday juga banyak mempopulerkan istilah-istilah kimia, seperti elektroda, elektrolit, anoda, katoda, dan sebagainya. Rumus Hukum Faraday Selain memiliki bunyi yang berbeda, hukum Faraday 1 dan 2 juga memiliki rumus yang berbeda. Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1 G ≈ Q atau G ≈ it Keterangan:
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Pada tahun 1834, seorang ilmuwan bernama Michael Faraday merumuskan suatu hukum terkait hubungan antara arus listrik yang dialirkan ke dalam larutan dengan banyaknya zat kimia yang dihasilkan. Percobaan dari Michael Faraday ini kemudian menghasilkan Hukum Faraday I dan Hukum Faraday II.

Mengenal Bunyi Hukum Faraday Kimia Kelas 12
Hukum Faraday 1: Pengertian, Rumus, dan Contohnya Dilansir dari Modul Pembelajaran Kimia Kelas XII, Hukum Faraday 1 menyatakan bahwa massa zat yang diendapkan atau dilarutkan sebanding dengan muatan yang dilewatkan dalam sel dan massa ekivalen zat tersebut.
Faraday's Law of Induction, Flux & Induced EMF Physics
Rumus hukum Faraday 2. W1 / W2 = e1 / e2. Keterangan: W1 adalah massa zat 1 (gram) W2 adalah massa zat 2 (gram) e1 adalah massa ekuivalen zat 1. e2 adalah massa ekuivalen zat 2. Dari penjelasan di atas, pada dasarnya hukum Faraday digunakan untuk memperhitungkan aspek kuantitatif zat-zat yang terlibat dalam reaksi dalam sel elektrolisis.

Rumus Praktis Hukum Faraday Pojok Kimia
Hukum Faraday: Penerapan Dan Contoh Soal - Hukum Faraday menjelaskan tentang hubungan proses kimia dengan energi listrik.. Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday : w = 1/96.500 x I x t x ME. dengan w = massa zat yang dihasilkan (gram) I = arus listrik (ampere) t = waktu.

PPT HUKUM INDUKSI FARADAY PowerPoint Presentation, free download ID5738336
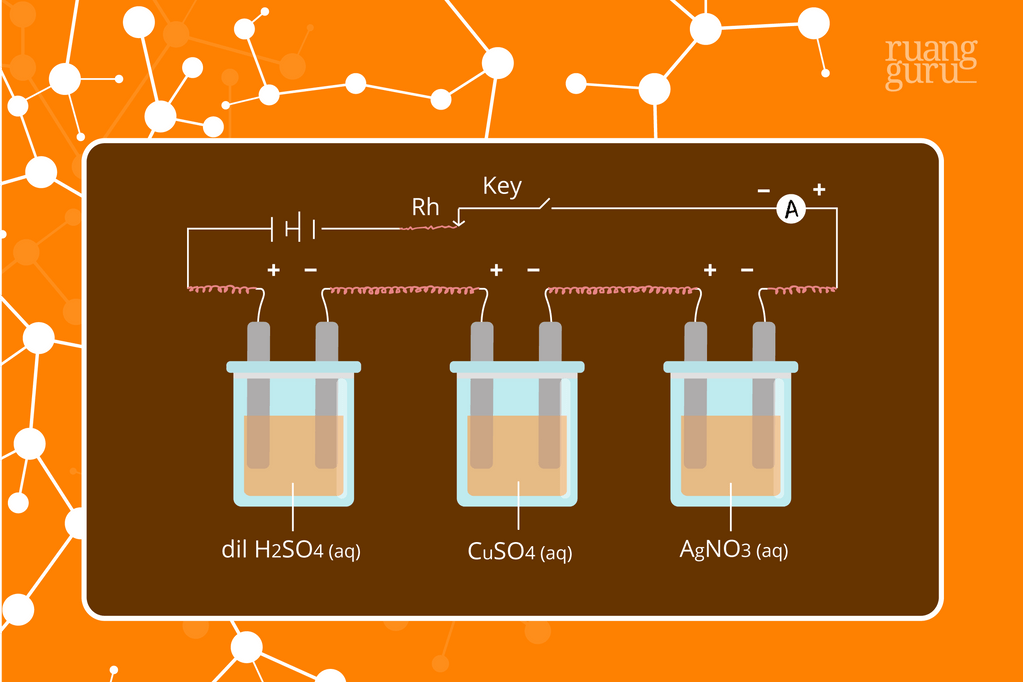
Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday: w = 1/96.500 x I x t x ME. dengan, Contoh soal Hukum Faraday . Arus listrik 0,2 ampere dilewatkan selama 50 menit ke dalam sel elektrolisis yang mengandung larutan CuCl 2. Hitunglah endapan Cu yang terbentuk pada katode.

K403 RedOks Elektrolisis (Penurunan Rumus Hukum Faraday) YouTube
Bunyi Hukum Faraday 1 dan 2, Beserta Rumus Faraday. Bunyi Hukum Faraday - Pengertian Hukum Faraday adalah salah satu hukum yang menyatakan bahwa hubungan antara jumlah listrik yang dipakai dengan Massa Zat yang dihasilkan pada proses Elektrolisis baik di Katoda maupun Anoda, dan Teori Faraday ini sering disebut juga dengan Teori Kuantitatif.

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 1) YouTube
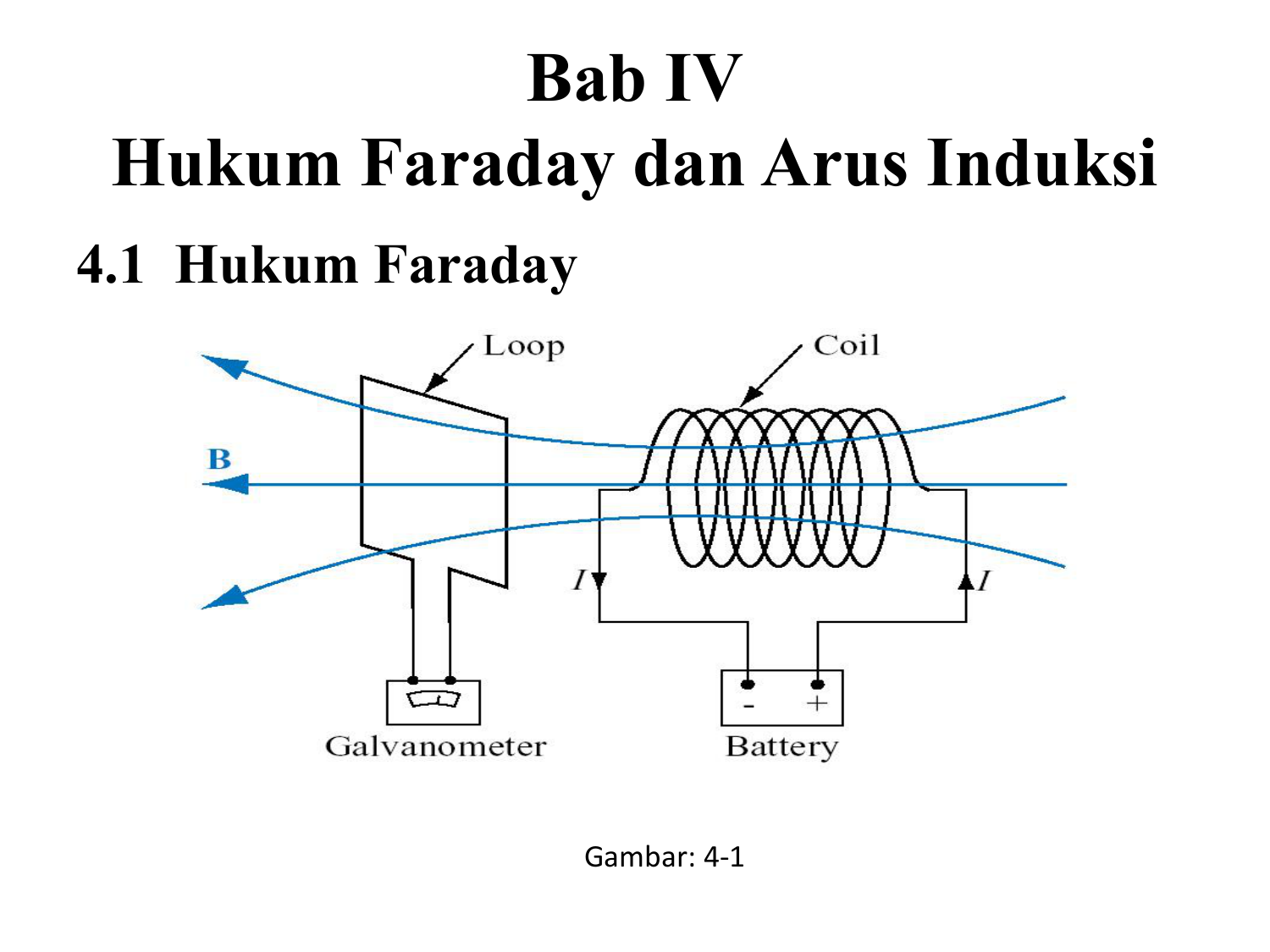
Hukum Faraday adalah suatu hukum tentang induksi elektromagnetik yang lahir dari seorang fisikawan dan kimiawan asal Inggris bernama Micahel Faraday. Dilansir dari Encyclopedia Britannica, induksi elektromagnetik pertama kali ditemukan dan diselidiki oleh Faraday. Kala itu pada tahun 1831 Faraday melakukan suatu percobaan tentang bagaimana.
PPT Faraday’s Law of Induction I PowerPoint Presentation, free download ID1058283
Jika diketahui bahwa Cu, wcu = 5 gram. Untuk menghitung MEcu dan MEag perlu menuliskan terlebih dahulu reaksi reduksi Cu dan Ag. apabila hukum Faraday I dan Faraday II digabungkan maka diperoleh w = I x t x ME, kemudian perbandingan ini menjadi persamaan dengan menambahkan faktor 1/96.500 dan diperoleh rumus hukum Faraday w= 1/96.500 x I x t x ME.

GGL Induksi Pengertian, Rumus, dan Penerapan Seharihari
Hukum Faraday I. "Massa zat yang dihasilkan pada suatu elektrode selama elektrolisis (G) berbanding lurus dengan jumlah muatan listrik yang digunakan (Q).". Secara matematis, hukum Faraday I dapat ditulis dalam persamaan berikut. Sebagaimana jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus listrik (i) dengan selang waktu (t.
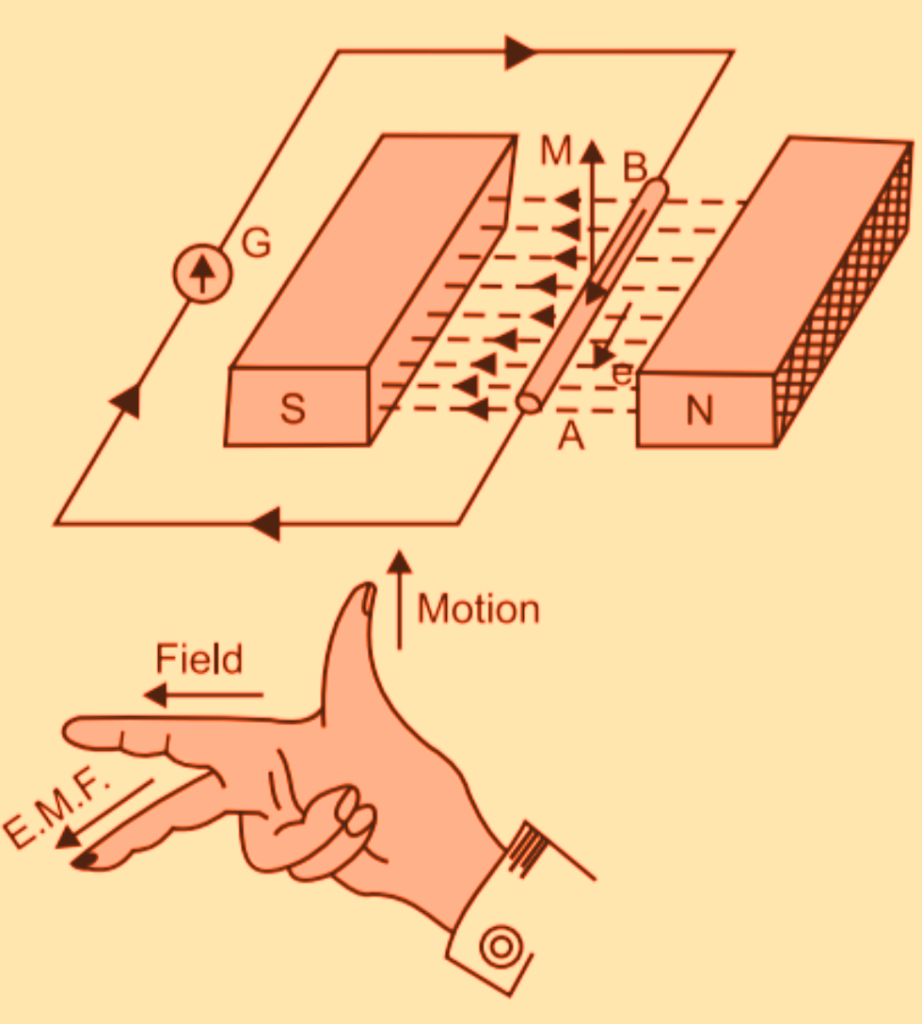
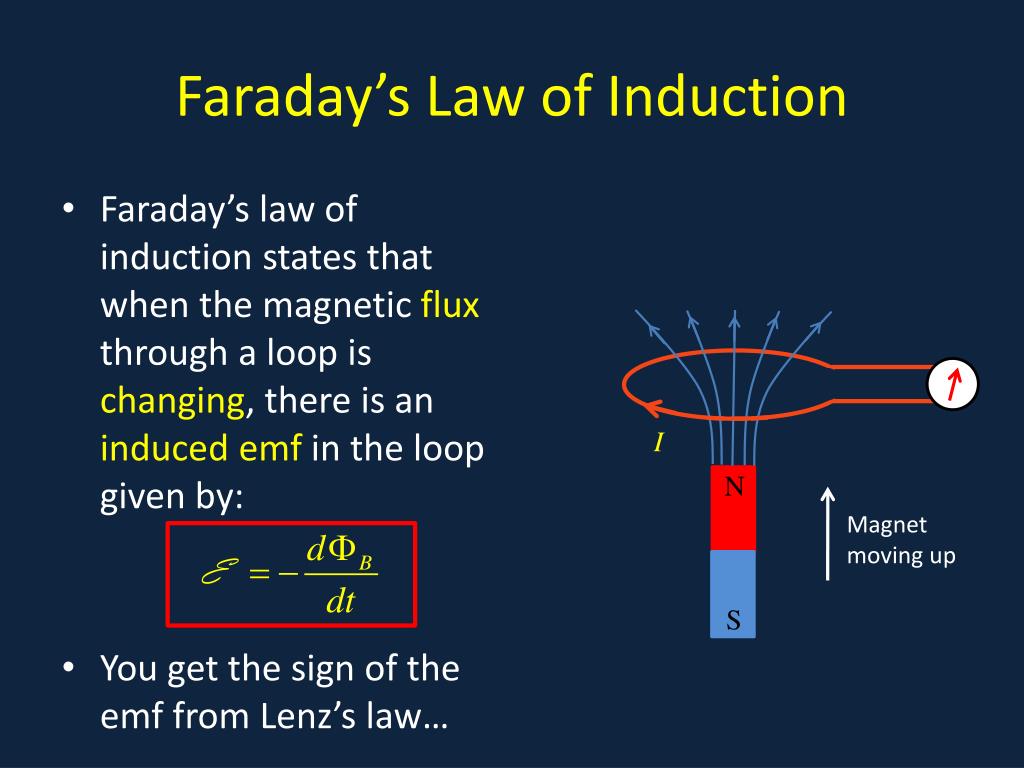
Faraday's law of induction
Massa zat yang terbentuk selama elektrolisis sebanding dengan massa ekivalen dan konstanta Faradaynya. Sehingga, rumus elektrolisis adalah: W = e x F W = e x c/96.500 W = (e x i x t)/96.500. W: massa zat yang diendapkan selama elektrolisis (g) e: massa ekivalen i: kuat arus (a) t: waktu (s) Pengertian dan Prinsip Kerja Sel Volta. Hukum Faraday II.

Rumus Hukum Faraday Bentuk turunan II YouTube
Rumus hukum Faraday - Dalam pelajaran kimia dan fisika, hukum faraday menjadi salah satu materi dasar yang penting diketahui karena berkaitan erat dengan kehidupan manusia yang modern. Berkat perannya, listrik bisa dinikmati oleh siapa saja. Bahkan, ada yang mengatakan bahwa tanpa hukum ini, listrik mungkin tidak akan menjadi hal yang sangat penting bagi kita sekarang.
Hukum Faraday dan Arus Induksi
Michael Faraday, ia adalah seorang ilmuan asal Inggris yang lahir pada 22 September 1791 di Newington Butts, Inggris. Kemudian ia dijuluki sebagai "bapak listrik", berkat usahanya listrik bisa jadi teknologi yang memiliki banyak kegunaan. Michael Faraday menjadi seorang ahli kimia dan fisika berkat mempelajari aspek kuantitatif dan.

Induksi Hukum Faraday (Fisika SBMPTN, UN, SMA) YouTube
Rumus Hukum Faraday. Selanjutnya kita akan mengetahui rumus hukum Faraday 1 yang menerangkan bahwa massa zat berbanding lurus dengan jumlah listrik yang digunakan. Rumus Hukum Faraday 1. G\approx Q atau G\approx I.t. Keterangan: G = massa dari proses elektrolisis (gram) I =arus listrik (A) Q = muatan listrik dalam sel (\varOmega) t = waktu (s)

Pengertian Hukum Faraday Dilengkapi Bunyi Rumus Dan Contoh Soal Riset
Secara sistematis, Hukum Faraday I dapat disimpulkan dengan persamaan berikut: w ≈ Q. Keterangan : w = massa zat (kg) Q = muatan listrik dalam elektron (C) Baca : Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya. Jumlah muatan listrik yang dipakai (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).