
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
NaOH disebut sebagai basa kuat dan NH 3 disebut sebagai basa lemah. A. Tetapan ionisasi asam (K a) Secara umum, reaksi kesetimbangan larutan asam HA dalam air dapat ditulis sebagai berikut.. Valensi basa adalah jumlah ion OH − yang dihasilkan per unit rumus basa. basa lemah (contoh: NH 3, CH 3 NH 2, C 6 H 5 NH 2)

Asam Basa Penentuan Ph Asam Kuat Dan Basa Kuat Lengkap Dengan Contoh Riset
Belajar Modul, Rumus, & Soal Titrasi Asam Basa dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Titrasi Asam Basa lengkap di Wardaya College.. Titrasi asam kuat oleh basa lemah dan sebaliknya pH ekivalen di bawah 7, sehingga bentuk kurvanya: Bila dilakukan titrasi sebaliknya (basa lemah oleh asam kuat) maka kurva dibalik menghadap kiri;

Contoh Asam Lemah Dan Basa Lemah Brain
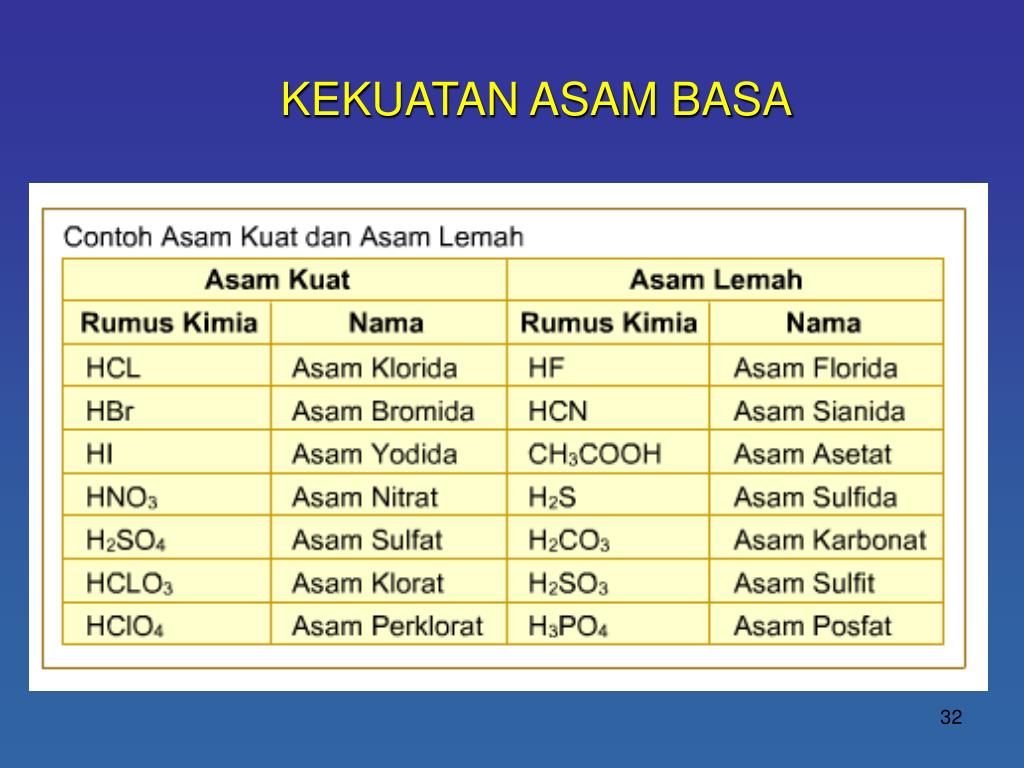
Berikut kami sajikan contoh asam kuat, asam lemah, basa kuat, basa lemah beserta rumus dan reaksi Ionisasinya. 7 Contoh asam kuat beserta rumus dan reaksi Ionisasinya. 1. Asam Klorida (HCl) Reaksi ionisasi: HCl → H+ + Cl- 2. Asam Nitrat (HNO3) Reaksi ionisasi : HNO3 → H+ + NO3- 3. Asam Sulfat (H2SO4) Reaksi ionisasi:

Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
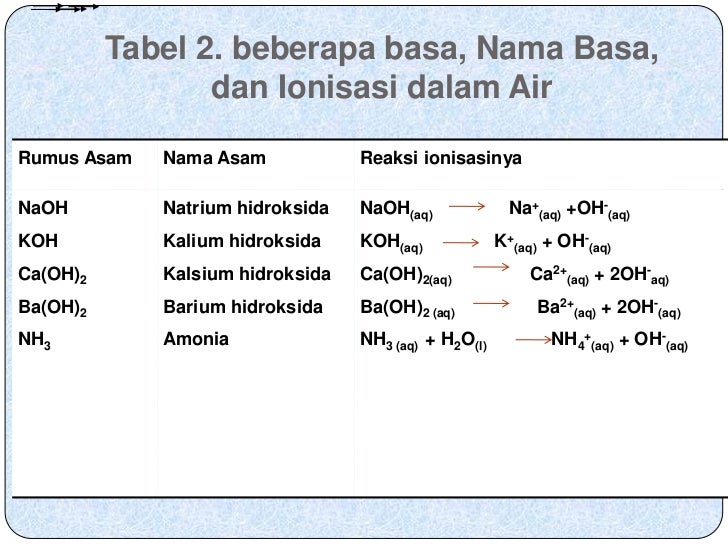
-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada dala air. Misalnya pada senyawa basa NaHCO3, NH4OH. - Manfaat senyawa basa dalam kehidupan: 1. Sodium hidroksida (NaOH) berguna untuk pembersih lemak dan bahan dasar sabun keras. 2. Kalium hidroksida (KOH) untuk bahan dasar sabun.

PERHITUNGAN pH ASAM LEMAH DAN BASA LEMAH YouTube
Fenol adalah senyawa yang bersifat asam lemah. Gugus hidroksil (-OH) yang terikat pada cincin aromatik fenol melepaskan proton (H+), membentuk ion fenolat (C6H5O-) yang stabil. Karena sifat asamnya, fenol bereaksi dengan basa kuat untuk membentuk garam fenolat.
Daftar Asam Basa Kuat Dan Lemah
Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat konsentrasi asam dengan pH 1 daripada 3.

pH Basa Kuat dan Basa Lemah YouTube
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.

Kekuatan Asam Kuat Dan Asam Lemah Rumus Kimia My XXX Hot Girl
Titrasi basa kuat oleh asam kuat, artinya: Titran (larutan standar pada buret) → asam kuat. Titrat (larutan sampel pada labu erlenmeyer) → basa kuat. Titrasi basa kuat oleh asam kuat akan menghasilkan kurva sebagai berikut. 3. Titrasi Asam Lemah oleh Basa Kuat.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Perbedaan Rumus Basa Kuat dan Lemah. Rumus basa adalah suatu bentuk persamaan kimia yang menunjukan reaksi antara senyawa basa dengan air untuk membentuk ion hidroksida (OH-) sebagai hasil akhir reaksi. Rumus basa biasa digunakan dalam pembelajaran kimia di SMA maupun sederajat. Dalam rumus basa, ada dua jenis yaitu basa kuat dan basa lemah.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Asam basa diklasifikasikan menjadi dua, yaitu asam basa kuat dan asam basa lemah. Berikut ini penjelasannya:. Rumus asam basa di bawah ini akan berguna saat pembuatan laporan praktikum titrasi asam basa. Sedikit informasi, titrasi asam basa adalah prosedur untuk menentukan kemolaran, kadar asam , atau basa berdasarkan netralisasi..
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
03 Maret 2023 Lili Y. Bagikan. 28 Contoh Asam Basa Kuat dan Asam Basa Lemah Beserta Reaksi Ionisasinya - Ketika kamu menambahkan soda kue ke cuka, maka akan menyebabkan gelembung dan busa. Ini merupakan reaksi antara asam dan basa. Asam dan basa dicirikan oleh pertukaran ion hidrogen. Asam adalah molekul yang menyumbangkan satu ion hidrogen.

Hidrolisis Garam dari Asam lemah dan Basa Kuat Rumus Kimia
Contoh basa kuat yaitu NaOH, KOH, dan Ba(OH) 2. 2. Asam Lemah dan Basa Lemah. Asam lemah adalah senyawa asam yang sulit melepaskan ion H + dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh asam lemah yaitu H 3 PO 4, H 2 SO 3, HNO 2, dan CH 3 COOH. Basa lemah adalah senyawa basa yang sulit melepaskan ion OH - dalam air dan.

Daftar Asam Basa Kuat Dan Lemah
Secara umum reaksi asam dan basa akan menghasilkan garam dan air. Pada reaksi asam kuat dan basa kuat, apabila jumlah (mol) keduanya sama-sama habis akan dihasilkan larutan bersifat netral. Sementara pada reaksi antara asam kuat dan basa lemah maupun basa kuat dan asam lemah terdapat beberapa skenario yang mungkin terjadi adalah sebagai berikut:

pH Campuran Basa lemah dan Basa Kuat Kimia SMA YouTube
1. Titrasi asam kuat-basa kuat. Pada terjadinya proses titrasi asam kuat dan basa kuat, maka kedua larutan akan terionisasi secara sempurna. Hal tersebut, disebabkan karena asam kuat dan basa kuat termasuk ke dalam larutan dengan kemampuan elektrolit kuat. Sehingga memungkinkan terjadinya ionisasi sempurna di dalam air.

TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
Basa Kuat. Pengertian basa kuat ialah jenis senyawa yang melepaskan proton (deprotonasi) pada asam sangat lemah secara sederhana dalam reaksi asam basa. Adapun contoh basa kuat yang paling umum ialah Hidroksida pada logan alkali, misalnya Ca (OH)2 maupun NaOH.
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
1. Basa Kuat - Kekuatan Basa Kuat dan Basa Lemah. Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan. Secara umum, ionisasi basa kuat dirumuskan sebagai berikut. M (OH)x(aq) ⇄ Mx+(aq) + x OH-(aq) dengan: x = valensi basa. M = konsentrasi basa.