
Elektrolisis Larutan Ki Ruang Belajar
Imbangi K2Cr2O7 + KI + HCl + Na2S2O3 = CrCl3 + KCl + H2O + Na2S4O6 + NaI persamaan atau reaksi kimia menggunakan kalkulator ini! ChemicalAid. ⚛️ Elemen . Tabel Periodik;. Untuk menyeimbangkan persamaan kimia, masukkan persamaan reaksi kimia dan tekan tombol Imbangi. Persamaan yang seimbang akan muncul di atas.

Persamaan reaksi kimia yang merupakan reaksi pada uji kua...
Penasaran tentang reaksi elektrolisis larutan KI? Baca artikel ini untuk mengungkap semua hal menarik tentang bagaimana elektrolisis bekerja pada larutan KI. Temukan bagaimana ion K dan I bereaksi dan membentuk senyawa baru yang menakjubkan. Dapatkan penjelasan langkah demi langkah yang mudah dimengerti dan temui beberapa aplikasi menarik dari reaksi ini dalam kehidupan sehari-hari.
KI + H2SO4 menjadi K2SO4 +I2 +H2S + H20, setarakn
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Elektrolisis larutan KI dengan elektrode C, reaksi yang t...
Langsung saja, mari kita bahas pelan-pelan tentang mengapa sel elektrolisis larutan KI bisa disebut sebagai keajaiban. Saat arus listrik melewati larutan KI, terjadi reaksi kimia yang sungguh menarik. Kalium iodida ini terurai dan menjadi dua komponen utama, yaitu kalium (K) dan iodin (I2). Begitu larutan KI terurai, kamu akan terpesona dengan.

H2O2 bertindak sebagai oksidator terdapat pada reaksi...
Seperti garam iodida lainnya, KI membentuk I 3 − ketika bergabung dengan iodin elemental. KI(aq) + I 2 → KI 3 (aq) Tidak seperti I 2, garam I 3 − sangat larut dalam air. Melalui reaksi ini, iodin digunakan dalam titrasi redoks. Larutan KI 3 berair, "larutan Lugol", digunakan sebagai desinfektan dan sebagai etsa untuk permukaan emas.

Pada elektrolisis larutan CuSO4 seperti terlihat pada gam...
Secara ringkas, Sobat bisa menggunakan bagan berikut ini agar lebih mudah untuk memprediksi reaksi yang akan terjadi pada sel elektrolisis. Bagan Elektrolisis. Contoh Reaksi Elektrolisis 1. Elektrolisis larutan KI dengan elektrode grafit. KI(aq) → K+(aq) + I−(aq) K termasuk logam golongan IA, sehingga air akan tereduksi di katode. Oleh.

Reaksi Dari FeCl3 dan KI HIDUPKU
Komposisi reaksi redoks dengan variasi KI Volume (mL) Percobaan KI H2O K2S2O8 Na2S2O3 Kanji 1 10 10 5 0.5 2 2 5 15 5 0.5 2 3 2,5 17,5 5 0.5 2 4 20 0 5 0.5 2 Pengaruh ion persulfat terhadap laju reaksi dengan variasi konsentrasi K2S2O8 dan konsentrasi KI konstan.

Perhatikan diagram sel elektrolisis larutan KI berikut!e
Setarakan jumlah muatan dengan menambahkan sejumlah e - pada ruas yang lebih positif. 2KI + H2SO4 → K2SO4 + I2 + 2H+ + 2e-. H2SO4 + 8H+ + 8e- → H2S + 4H2O. Seimbangkan jumlah elektron yang dilepas dengan yang diterima dengan mengali-lipatkan dengan angka tertentu untuk semua spesi pada reaksi yang perlu dikali-lipatkan.

Setarakan reaksi KI + BeCI2 in 2022 Sekolah menengah, Desain grafis, Kimia
Word Equation. Potassium Iodate + Potassium Iodide + Sulfuric Acid = Diiodine + Potassium Sulfate + Water. One mole of aqueous Potassium Iodate [KIO 3], five moles of aqueous Potassium Iodide [KI] and three moles of aqueous Sulfuric Acid [H 2 SO 4] react to form three moles of solid Diiodine [I 2], three moles of aqueous Potassium Sulfate [K 2 SO 4] and three moles of liquid Water [H 2 O]

Perhatikan gambar elektrosis larutan KI dengan elektroda
Jadi, reaksi elektrolisis ki dengan elektroda karbon merupakan proses menarik yang terjadi ketika arus listrik dialirkan melalui larutan ki menggunakan elektroda karbon. Proses ini menghasilkan endapan iodin (I2), gas iodin (I2), dan gas oksigen (O2), yang dapat kita amati dengan mata telanjang.

SOLVED Setarakan persamaan reaksi berikut menggunakan cara 1/2 reaksi ion elektron KIO3 + KI
Imbangi KI + H2O2 = KOH + I2 persamaan atau reaksi kimia menggunakan kalkulator ini! ChemicalAid. ⚛️ Elemen . Tabel Periodik; Tren Periodik; Elemen Masa Depan; 🛠️ Kalkulator.. Untuk menyeimbangkan persamaan kimia, masukkan persamaan reaksi kimia dan tekan tombol Imbangi. Persamaan yang seimbang akan muncul di atas.
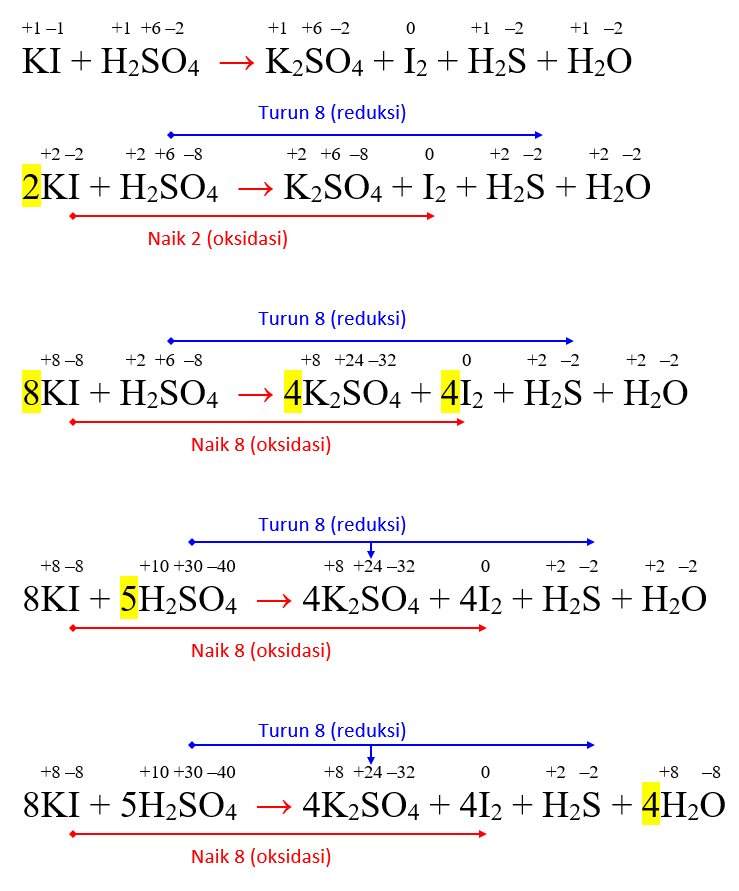
Penyetaraan Reaksi Redoks KI + H2SO4 → K2SO4 + I2 + H2S + H2O Markas Belajar
Reaksi Anoda dibedakan menjadi 2 , yaitu. a. elektroda inert (Pt, C intan/grafit dan Au) jika dalam polianion tidak teroksidasi sedangkan. monoanion akan teroksidasi. b. elektroda non inert maka elektroda tersebut terlibat dalam reaksi oksidasi. Berdasarkan konsep elektrolisis maka dapat dituliskan untuk reaksi elektrolisis dari larutan KI.

Reaksi Dari FeCl3 dan KI HIDUPKU
Untuk menyeimbangkan persamaan kimia, masukkan persamaan reaksi kimia dan tekan tombol Imbangi. Persamaan yang seimbang akan muncul di atas. Gunakan huruf besar untuk karakter pertama dalam elemen dan huruf kecil untuk karakter kedua. Contoh: Fe, Au, Co, Br, C, O, N, F. Cas ionik belum didukung dan akan diabaikan.

Direaksikan 200 ml Pb(NO_(3))_(2) 1 M dengan 33,2 gram
Tanpa tahu biloks reaksi redoks dapat disetarakan. Penyetaraan reaksi: KMnO4 + KI + H2O → MnO2 + KOH + I2 (suasana basa) menggunakan metode setengah reaksi.

Reaksi Dari FeCl3 dan KI HIDUPKU
Reaksi kimia atau tindak balas kimia adalah suatu proses alam yang selalu menghasilkan antarubahan senyawa kimia.. (II) iodida dan kalium nitrat, dengan persamaan reaksi: Pb(NO 3) 2 + 2 KI → PbI 2 + 2 KNO 3. Contoh lainnya adalah natrium klorida (garam dapur) bereaksi dengan perak nitrat membentuk natrium nitrat dan perak klorida, dengan.

Elektrolisis Pembuatan Yodium Pembahasan soal UN 2015 tentang Elektrolisis larutan KI YouTube
Reaksi elektrolisis lelehan ki adalah suatu proses kimia yang dilakukan dengan menggunakan arus listrik untuk memecah senyawa kalium iodida (KI) yang berada dalam keadaan meleleh. Reaksi ini terjadi di dalam suatu sel elektrolisis yang terdiri dari dua elektroda, yaitu anoda yang terbuat dari bahan inert seperti grafit atau platinum, dan katoda.