
Hitunglah Ph Larutan Yang Terbentuk Dari Campuran Berikut B Ml Hot Sex Picture
B. Perhitungan pH Larutan Penyangga 1. Campuran yang terdiri dari 100 mL HCN 0,1 M (Ka = 2 x 10-5) dan 100 mL KCN 0,2 M akan memiliki pH sebesar…. A. 9 + log 2. B. 9 - log 2. C. 5 + log 2. D. 5. E. 5 - log 2. Kunci Jawaban: D. Pembahasan: 2. Suatu larutan penyangga dibuat dengan mencampurkan 200 mL larutan NH 4 OH 0,1 M dengan 100 mL.

Jika Ka CH3COOH = 105 maka pH dari 100 mL larutan CH3COONa 0,1 M adalah…. YouTube
Tentukan pH larutan penyangga yang dibuat dengan mencampurkan 50 mL larutan CH3COOH 0,1 M dengan 50 mL larutan NaCH3COO 0,1 M. (KaCH3COOH =1,8 × 10-5) Pertama, mencari mol dari masing-masing larutan dengan menggunakan rumus molaritas, nCH 3 COOH nCH 3 COONa MCH3COOH = Volume larutan MCH3COONa = Volume larutan nCH 3 COOH 0,1 = 0,05 0,1 M = nCH.
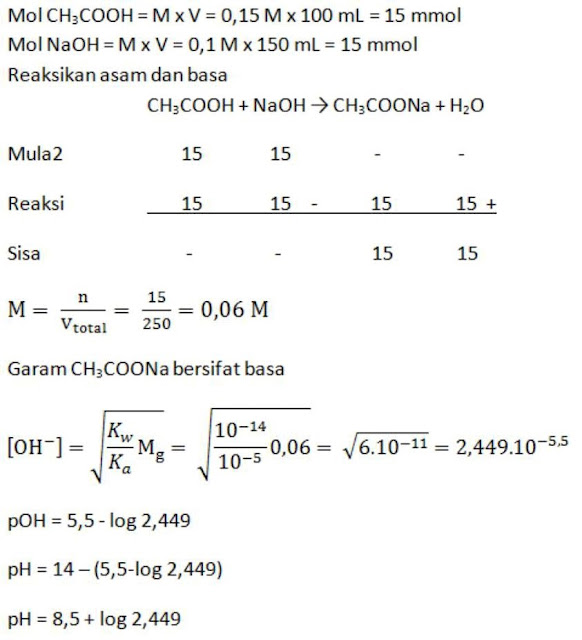
Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur dengan 150 mL larutan NaOH 0,1 M (Ka
Tentukan PH dari 200ml CH3COOH 0,1M yang dicampur dengan 100ml CH3COOK 0,2M, jika Ka= 10-5. maka diketahui bahwa campuran larutan pada soal merupakan larutan penyangga asam, karena terdiri dari CH3COOH (asam lemah) dan CH3COO- (dalam CH3COOK, basa konjugasi). Selanjutnya penentuan pH dari larutan, perhatikan gambar berikut ya ^_^ Beri Rating.

Bahas Soal Menentukan pH Campuran, 100 mL CH3COOH 0,05M dan 100mL KOH 0,05M, Ka CH3COOH = 1 x
pH merupakan kepanjangan dari power of Hydrogen.. Menghitung pH dari larutan campuran; Menghitung pH dan pOH Dari Asam Basa Kuat.. Sebayak 50 ml larutan HNO 2 1 M dicampurkan ke dalam larutan NH 4 OH 0,5 M sebanyak 100 ml. Tentukan pH larutan yang dihasilkan! (Ka HNO 2 = 7 x 10-4,.

Hitunglah pH larutan dari a. Larutan NaCN 0,1 M (Ka HCN = 4 x 106) b. CH3COONH4 0,1 M (KA
Mengutip e-modul Kimia: Peranan Elektrolit dalam Tubuh (2017) yang diterbitkan Kemdikbud, definisi larutan adalah campuran homogen yang tersusun dari pelarut dan zat terlarut. Secara umum larutan kerap dikenal dalam bentuk zat cair. Namun, sebenarnya larutan juga bisa berbentuk gas dan padat. Contoh larutan berupa gas adalah gas nitrogen.

pH campuran dari 20 mL larutan CH3COOH 0,3 M(Ka=1 x 10...
Adanya ion OH− menunjukkan bahwa garam bersifat basa. Untuk mengetahui pH campuran, maka perlu dihitung dengan cara berikut. 1. Menentukan mol awal CH3COOH dan NaOH. mol CH3COOH mol NaOH = = = = = = [CH3COOH] ×volume CH3COOH 0,2 M× 100 mL 20 mmol [NaOH]× volume NaOH 0,2 M× 100 mL 20 mmol. 2.

Suatu campuran penyangga yang terbentuk dari 500 mL larutan HCOOH 1 M dan 500 mL larutan HCOONa
7. pH dari larutan yang merupakan campuran dari 100mL CH3COOH 0,2 M dan 100 ml NaOH 0,2 M , jika Ka CH3COOH = 10-5 adalah.. A. 9 B. 8 C. 7 D. 10 E. 11 8. Jika 50mL HClO4 0,1M bereaksi dengan 50mL basa lemah LOH 0,1M dan pH campuran yang 26 | P a g e HIDROLISIS GARAM terbentuk adalah 6, maka tetapan kesetimbangan basa lemah tersebut adalah.
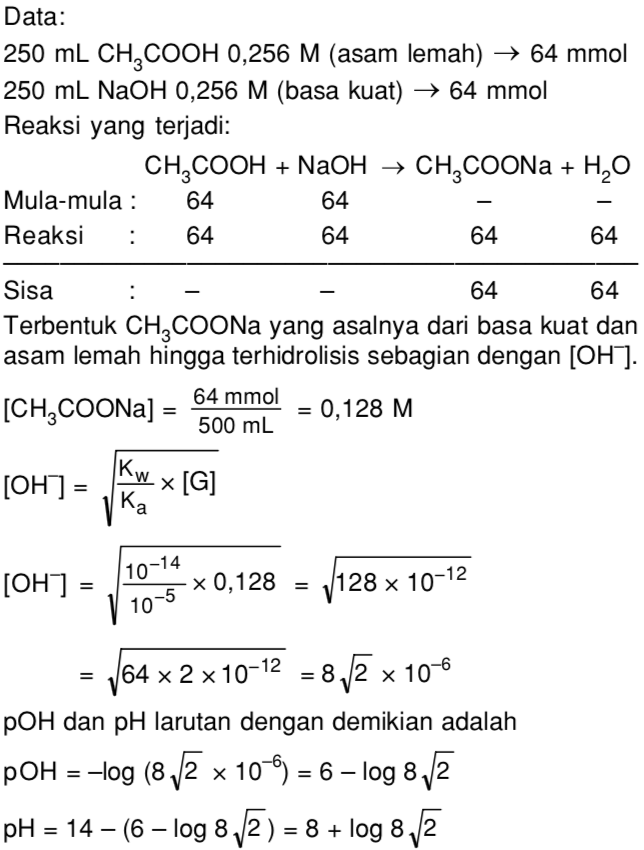
Campuran 250 mL CH3COOH 0,256 M dengan 250 mL NaOH 0,256 M akan menghasilkan pH larutan Mas Soal
Sebaliknya ketika basa kuat ditambahkan ke dalam campuran, konsentrasi ion hidrogen. Hitung pH dari 0.5 L larutan buffer yang terbentuk dari 0.7 M asam format (HCOOH) dengan 0.5 M natrium format. Tentukan pH larutan ketika 25 mL larutan asam asetat 0.2 M dicampurkan dengan 35 mL larutan NaOH 0.1 M (diketahui pKa asam asetat = 4.752).

Hitunglah ph larutan campuran 100 ml CH3COONa 0,01 M dengan 100 ml CH3COOH 0,02 M Universityku
pH dari larutan yang merupakan campuran dari 100 mL CH3COOH 0,2 M dan 100 ml Ca (OH)2 0,1 M, jika Ka CH3COOH = 10^ (-5) adalah. pH Larutan Garam. Kesetimbangan Ion dan pH Larutan Garam. Kimia Fisik dan Analisis.
10 Hitung pH campuran 20 mL larutan CH3COOH 0,1 M
Kedua, campuran tersebut bukan merupakan Larutan penyangga karena yang berlebihan adalah NaOH yang merupakan basa kuat. 7. Suatu larutan terdiri dari campuran antara NH3 dengan konsentrasi 0,1 M sebanyak 50 mL dan 100 mL larutan NH4Cl 0,5 M. Tentukan apakah ia merupakan larutan penyangga!
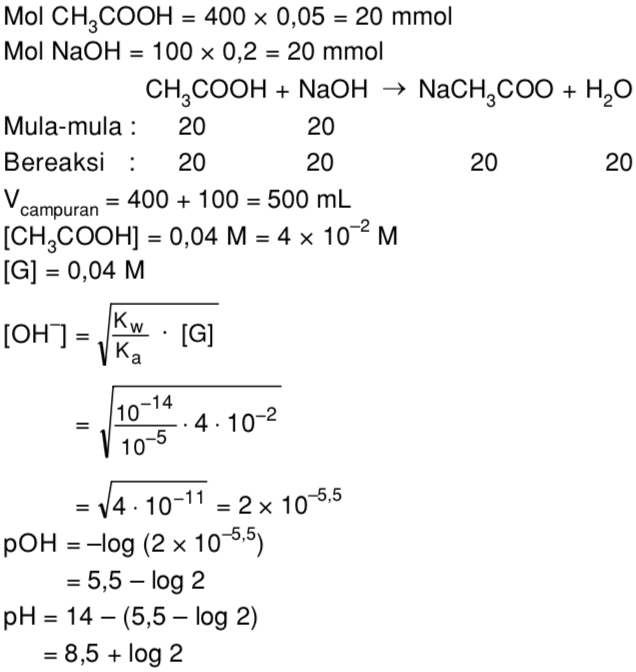
Sebanyak 400 mL larutan CH3COOH 0,05 M direaksikan dengan 100 mL larutan NaOH 0,2 M Mas Dayat
Skala pH biasanya berkisar dari 0 hingga 14. Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat.

Hitunglah Ph Larutan Yang Terbentuk Dari Campuran Berikut A Ml Hot Sex Picture
Ka > Kb B. Ka < Kb C. Kb > Ka D. Ka = Kb E. Kb > Ka 10. pH dari larutan yang merupakan campuran dari 100mL CH3COOH 0,2 M dan 100 ml NaOH 0,2 M , jika Ka CH3COOH = 10-5 adalah.. A. 9 B. 8 C. 7 D. 10 E. 11 @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 24 Modul Kimia Kelas XI KD 3.11 KUNCI JAWABAN No Jawaban 1 A 2 D 3 D 4 B.

Menghitung pH Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur dengan 150 mL larutan NaOH 0
️ Tonton video solusi yang udah dicek kebenarannya. Solusi ngerjain latihan soal Kimia kelas 11 materi pH Larutan Garam. Sebanyak 100 ml larutan CH3COOH 0,2 M dicampur dengan 100 ml larutan NaOH 0,2 M. Jika Ka CH3COOH=10^(-5) maka pH larutan setelah dicampur adalah.. pH Larutan Garam; Kesetimbangan Ion dan pH Larutan Garam;

pH dari larutan yang merupakan campuran dari 100 m...
Jadi, berdasarkan perhitungan nilai pH nya adalah 8,5 dan larutan garam tersebut bersifat basa. Contoh Soal 2. Jika 100 mL NH 4 OH 0,4 M direaksikan dengan 100 mL larutan HCl 0,4 M Kb NH 4 OH = 2 x 10-6. Tentukan pH campuran setelah bereaksi! Jawab: Diketahui larutan garam yang dihasilkan merupakan campuran dari senyawa asam kuat dan basa lemah.

Jika Diketahui Ka Ch3Cooh 1X105 Maka Ph Campuran
pH Larutan Garam. pH dari larutan yang merupakan campuran dari 100 mL CH3 COOH 0,2 M dan 100 ml NaOH 0,2 M , jika Ka CH3 COOH=10^ (-5) adalah.. a. 9 d. 10 b. 8 e. 11 c. 7. pH Larutan Garam. Kesetimbangan Ion dan pH Larutan Garam. Kimia Fisik dan Analisis. Kimia.

Hitunglah Ph Larutan Yang Terbentuk Dari Campuran Berikut Lengkap
Maka hanya penambahan NaOH yang akan mempengaruhi p H dan bereaksi: [ H +] = 7, 5 × 10 − 3 × 2, 95 mmol 2, 26 mmol = 9, 789 × 10 − 3 p H = 2, 01. Belajar pH Larutan Penyangga dengan video dan kuis interaktif. Dapatkan pelajaran, soal & rumus pH Larutan Penyangga lengkap di Wardaya College.