
tunjukkan mana yang bertindak sebagai asam dan basa Lewis pada reaksi berikut Brainly.co.id
Pada gambar di sebelah kanan, satu molekul H2O bertindak sebagai basa dan mendapatkan H + menjadi H3O+ sementara lainnya bertindak selaku asam dan kehilangan H+ dan menjadi OH −. Contoh lain dapat dilihat pada aluminium hidroksida Al (OH)3. Asam Basa pH - Rumus Kimia - Penjelasan, Contoh Soal dan Jawaban.

H2O2 bertindak sebagai oksidator terdapat pada reaksi...
Reaksi Asam-Basa. Misalnya, ketika asam klorida, HCl, dan natrium hidroksida , NaOH, dicampur, H + bereaksi dengan OH - untuk membentuk air: H + (aq) + OH - (aq) → H 2 O. HCl bertindak sebagai asam dengan menyumbangkan ion H + atau proton dan NaOH bertindak sebagai basa, memberikan ion OH - .

Sifat Asam Dan Basa Dari Air
Pada reaksi mana air dapat bertindak sebagai basa? A. H2O + H2SO4 H3O+ + HSO4-B. H2O + CO32 - OH- + HCO3-C. H2O + CO2 H2CO3 D. H2O + NH3 NH4+ + OH-. Prinsip kerja larutan penyangga basa sebagai berikut : 1) Pada penambahan asam Bila yang ditambahkan suatu asam, maka Ion H+ dari asam akan mengikat

Contoh Soal Reaksi Asam Basa Konjugasi Kumpulan Contoh Soal My XXX Hot Girl
Air dapat menjadi pelarut dari berbagai macam zat termasuk untuk menjadi pelarut pada asam dan basa.. Mengutip dari modul Interaksi Alam Basa dan Kehidupan (2018) Kemdikbud, sebagai pelarut yang mampu melarutkan banyak macam zat, air memiliki sifat elektrolit yang lemah. Molekul air mudah terionisasi dari H2O menjadi: ion H+ dan OH- Dengan.
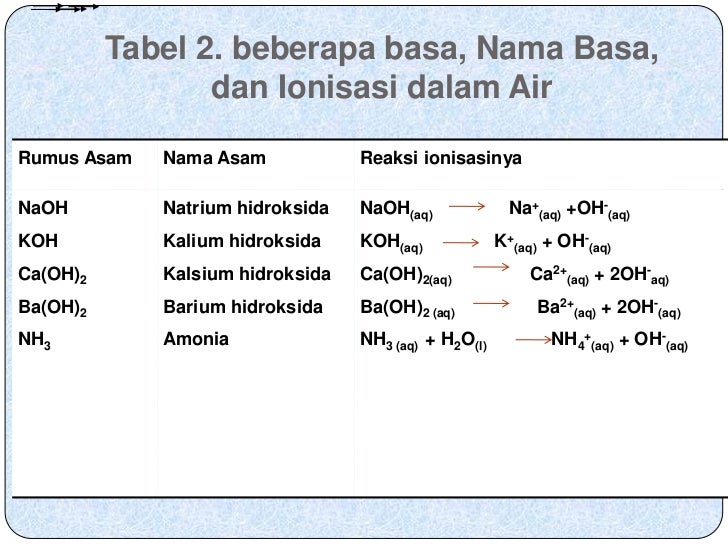
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Beberapa zat dapat bertindak sebagai asam, namun juga dapat sebagai basa pada reaksi yang lain, misalnya H 2 O, HCO 3 −, dan H 2 PO 4 −.Zat demikian disebut amfiprotik. Suatu zat amfiprotik (misalnya H 2 O) akan bertindak sebagai asam bila direaksikan dengan zat yang lebih basa darinya (misalnya NH 3) dan bertindak sebagai basa bila direaksikan dengan zat yang lebih asam darinya (misalnya.

Teori Asam Basa
Air dapat bersifat amfiprotik, yaitu spesi yang dapat menerima dan mendonorkan proton (H +), sehingga dapat bertindak sebagai asam maupun basa. Air bertindak sebagai basa apabila H 2 O dapat menerima satu proton dari pasangan reaksinya. Sehingga, reaksi yang menunjukkan air bersifat basa adalah reaksi berikut: Jadi, jawaban yang benar adalah A.

Reaksi Asam Basa Read HSTKB
Contoh senyawa amfoter yang paling dekat dengan manusia adalah air (H2O). Air dapat bertindak sebagai basa dengan menerima proton saat bereaksi dengan asam.. chem.libretexts.org Reaksi air dengan HCL di mana air bertindak sebagai basa dan reaksi air dengan NH3 di mana air. Jawaban dari Soal "Persamaan Lingkaran yang Berpusat Pada Titik (4.

tunjukkan mana yang bertindak sebagai asam dan basa Lewis pada reaksi berikut Brainly.co.id
Larutan tersebut bisa mengalami disosiasi total dalam larutan. Sementara basa kuat adalah senyawa basa yang bila dilarutkan dalam air akan melepaskan ion OH - dengan mudah. Sementara itu, asam kuat + basa kuat = netral. Artinya apabila reaksi asam kuat dicampurkan dengan basa kuat akan menghasilkan larutan dengan pH 7 atau netral. Asam basa lemah

Mengenali Reaksi Kimia
Dijelaskan dalam Jurnal UNY, teori Arrhenius menyimpulkan: 1. Asam: zat/senyawa yang dapat menghasilkan H+ dalam air. HCl (aq) à H+ (aq) + Cl - (aq) 2. Basa: zat/senyawa yang dapat menghasilkan OH- dalam air. NaOH (aq) à Na+ (aq) + OH - (aq) • Reaksi netralisasi adalah reaksi antara asam dengan basa yang menghasilkan garam:

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Asam = donor H+. Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20.
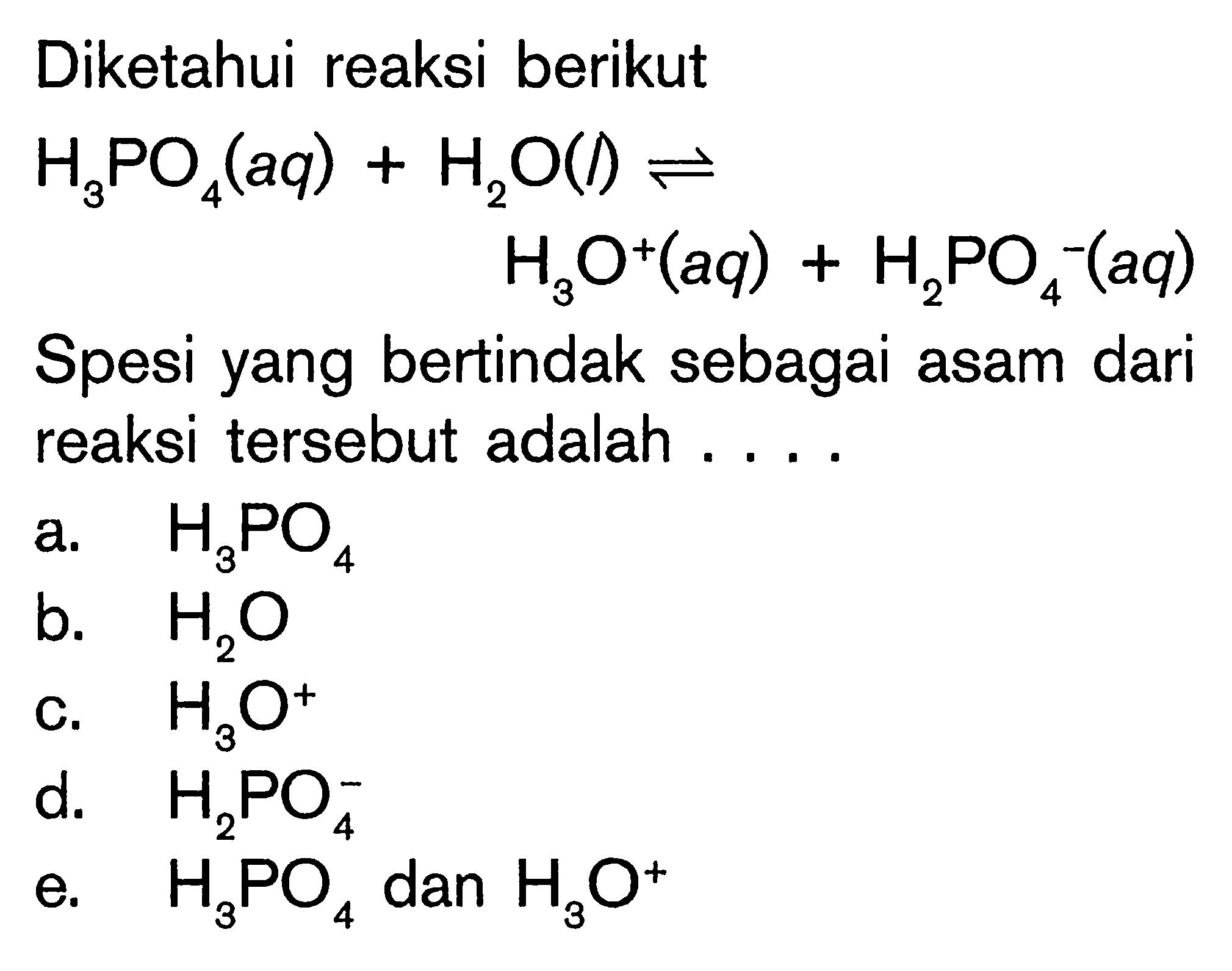
Sebutkan pasangan asambasa konjugasi dari reaksi berikut...
Di dalam cairan lambung ini, yang bertindak sebagai larutan penyangga ternyata sangat kompleks, lho. Salah satu contohnya adalah campuran ion bikarbonat (HCO 3 -) dan ion karbonat (CO 3 2-). Campuran ini dapat mencegah perubahan pH yang drastis pada lambung, sehingga mencegah kerusakan lambung akibat pH makanan yang berubah-ubah. Misalkan.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Teori ini juga berguna dalam menjelaskan pengaruh larutan asam dan basa pada reaksi kimia dan pengembangan teknologi kimia organik.. di mana logam sentral dapat bertindak sebagai asam dan molekul pendonor elektron dapat bertindak sebagai basa. Dalam senyawa kompleks, logam sentral umumnya memiliki kecenderungan untuk menerima pasangan.

Perhatikan reaksi berikut. NH3+H2O NH4^(+)+OH^() Menur...
Hallo ka Tiara T. Kaka bantu jawab yaa.. Izin mengoreksi ya ka, mungkin maksudnya "HSO4-" bukan "HSO4+" Jawaban: reaksi A : H2O + H2SO4 --> H3O+ + HSO4- Agar lebih paham simak pembahasan berikut ya^^ Teori asam basa menurut Bronsted-Lowry yaitu sebagai berikut: - Asam adalah zat yang memberikan atau donor proton (H+) - Basa adalah zat yang dapat menerima atau akseptor proton (H+) - Asam.

Peran Sentral Konsep AsamBasa dalam Reaksi Kimia Organik
Pada dasarnya reaksi redoks berlangsung di dalam pelarut air sehingga penyetaraan persamaan reaksi redoks selalu melibatkan ion H+ dan OH-. Terdapat dua metode untuk menyetarakan reaksi redoks, yaitu dengan cara bilangan oksidasi dan cara setengah reaksi (Vinsiah, 2020).
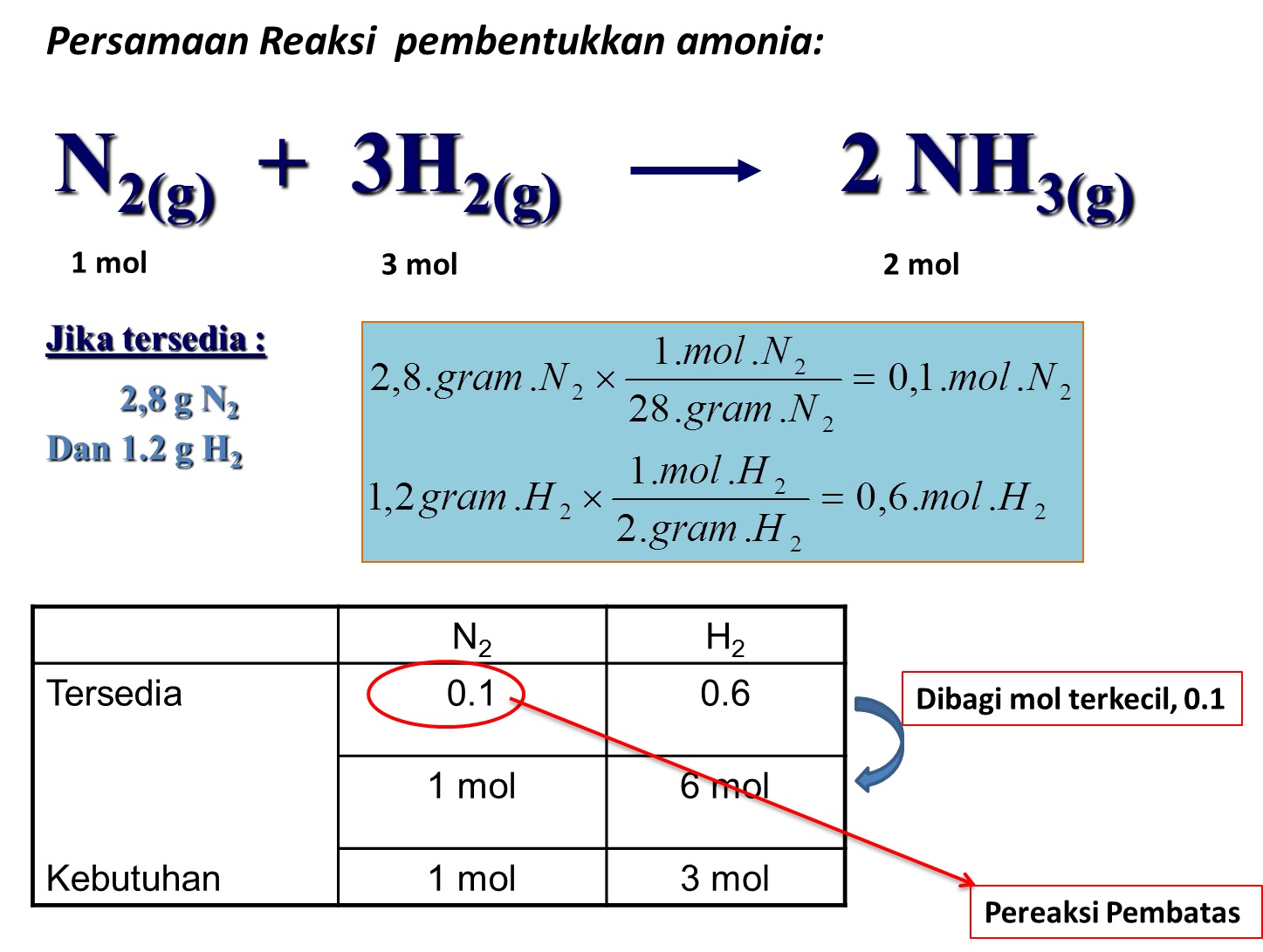
5 Tahapan Reaksi Kimia kabarmedia.github.io
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).