Berapa mol yang terdapat dalam atom/molekul beriku...
Maka, jawabannya adalah n p = d. 0,8 mol. 2. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat terlarut awal dalam larutan tersebut adalah…. a. 0,1 mol. b. 0,2 mol. c. 0,3 mol. d.

Contoh Soal Molaritas Dan Pembahasannya
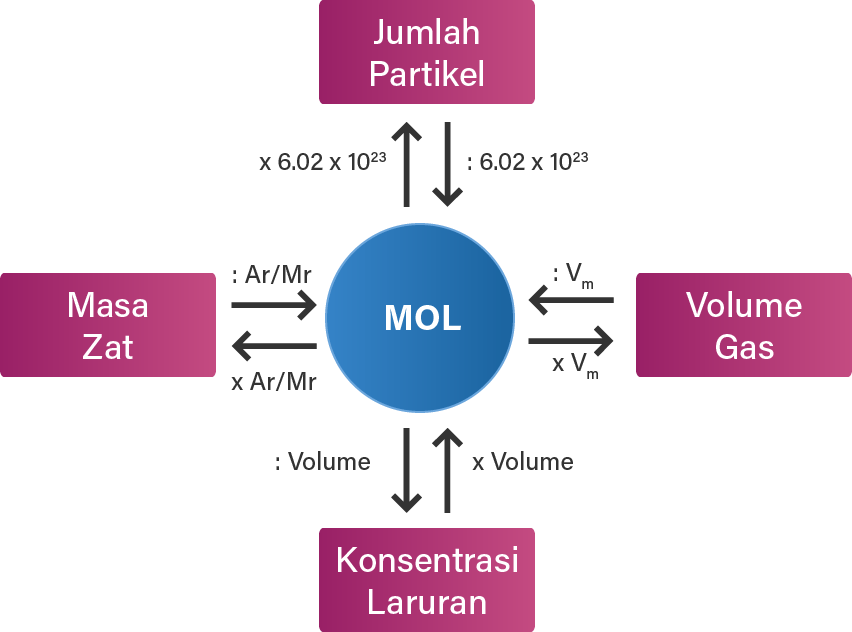
Mol adalah jumlah dari suatu zat yang mengandung jumlah satuan dasar (atom, molekul, dan ion) yang sama dengan atom-atom dalam 12 g isotop karbon (C-12). Mol merupakan satuan dasar SI untuk sejumlah zat. Pengertian mol dapat kita analogikan sebagai berikut. Apabila kita menghitung telur dengan satuan lusin (12 telur), dan kertas dengan satuan rim (500 lembar), maka ahli kimia menghitung jumlah.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Apa Arti m dan M dalam Kimia? Baik m dan M adalah satuan konsentrasi larutan kimia. Huruf kecil m menunjukkan molalitas, yang dihitung menggunakan mol zat terlarut per kilogram pelarut. Suatu larutan yang menggunakan satuan-satuan ini disebut larutan molal (misalnya, 0,1 m NaOH adalah larutan 0,1 molal natrium hidroksida).

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Fraksi Mol dalam Kimia Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan perbandingan jumlah mol sebagian zat terhadap jumlah mol total komponen larutan. Dalam kimia, fraksi mol didefinisikan sebagai jumlah konstituen dibagi dengan jumlah total semua konstituen dalam suatu campuran : Jumlah semua fraksi mol sama dengan 1: Fraksi mol juga disebut fraksi jumlah dan identik dengan.

Kimia Tingkatan 4 KSSM Bab 3 Konsep Mol (Bahagian 1) Konsep Mol, Formula dan Persamaan Kimia
Penggunaan Satuan Mol dalam Ilmu Kimia sangat banyak, seperti dalam perhitungan reaksi kimia, pembuatan obat-obatan, produksi industri, dan sebagainya. Oleh karena itu, pemahaman mengenai konsep mol dan satuan mol sangat penting dalam memahami ilmu kimia secara menyeluruh.. Contoh penggunaan rumus ini adalah dalam menghitung jumlah molekul.

Soal Mol Penjelasan Lengkap dan Komprehensif tentang Mol dalam Kimia
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.
KONSEP MOL KIMIA KELAS 10, ANAK IPA WAJIB NONTON! YouTube
Pengertian Konsep Mol, 4 Rumus, dan Contoh Soalnya. Oleh Ilmu Kimia Diposting pada 8 Januari 2022. Konsep mol bisa dikataan sebagai ilmu dasar yang harus dikuasai dalam mempelajari penerapan kimia yang lebih dalam. Kita tidak dapat menghindarinya karena ilmu kimia modern telah mengeksplorasi aspek secara kualitatif dan kuantitatif.

Konsep Mol Kimia Lengkap Pengertian, Penjelasan, Istilah, Latihan Soal dan Pembahasannya
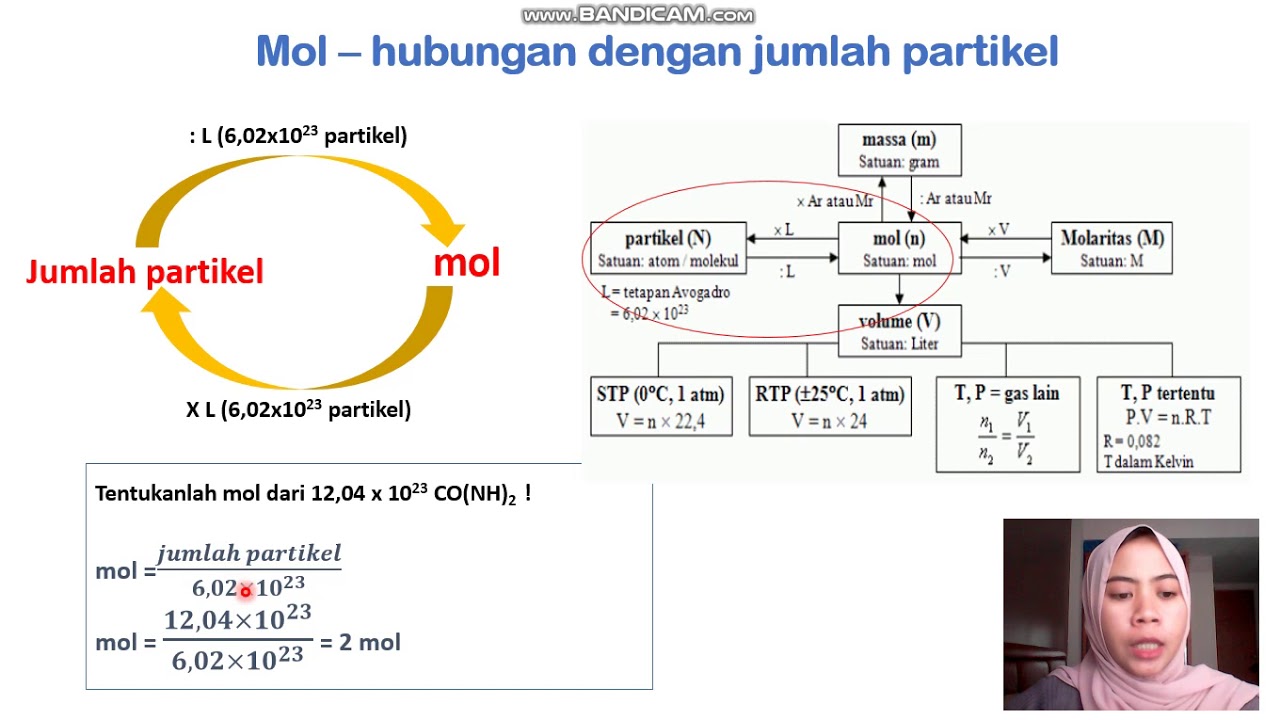
Kecilnya partikel dalam suatu reaksi kimia menyulitkan kita untuk mengukur seberapa banyak maka digunakanlah konsep mol.. Bilangan Avogadro menyatakan bahwa dalam satu mol zat, terdapat partikel sejumlah 6,02214076x10^23. Baca juga: Pengertian dan Contoh Soal Fraksi Mol. Contohnya adalah 1 mol air mengandung 6,02214076x10^23 partikel air.

Pengertian Mol Konsep dan Penggunaannya dalam Kimia
Ilmu kimia adalah ilmu yang berlandaskan eksperimen, dimulai dari pengamatan, kemudian diperoleh data yang selanjutnya didapatkan keteraturan. Keteraturan yang diperoleh secara eksperimen disebut hokum.. Jadi, dalam satu mol suatu zat terdapat 6,022 x 10²³ partikel. Nilai 6,022 x 10²³ partikel per mol disebut sebagai tetapan Avogadro.

MOL Ilmu Kimia
Materi konsep mol. Bagaimana cara menghitung zat-zat yang bereaksi dalam suatu reaksi kimia? Para ahli kimia yang bergabung dalam IUPAC (International Union Pure and Applied Chemistry) sepakat menggunakan satuan yang disebut mol. Satu mol adalah jumlah partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan partikel yang terdapat dalam 12 gram atom C-12.

Konsep Mol dan Analisanya
Seperti soal sebelumnya, kita gunakan terlebih dahulu rumus mol namun terhadap volume gas STP. Selanjutnya kita bisa masukan ke dalam persamaan. Massa senyawa = Mr x Jumlah mol. 4,25 g = Mr x 0,125 mol. Mr = 34. Jadi, diketahui Mr dari 4,25 g gas dengan volume 2,8 L sebesar 34.

Konsep Mol Pada Kimia Rezfoods Resep Masakan Indonesia
Ringkasan Materi Konsep Mol dan Contoh Soalnya Konsep mol adalah sebuah konsep yang menghubungkan dunia makroskopik dan dunia molekular. Mol didefinisikan sebagai jumlah tertentu dari suatu partikel (atom, molekul, ion, atau partikel lain) yang mengandung jumlah partikel sama banyak dengan jumlah atom yang terkandung dalam 12 gram atom C-12. 1.

Contoh soal kimia tentang fraksi mol 2021
Mol (simbol: mol; bahasa Inggris dan Prancis: mole) adalah satuan pokok untuk besaran jumlah zat dalam Sistem Satuan Internasional (SI). Setelah redefinisi pada tahun 2019, definisi satuan mol, seperti yang disebutkan dalam Brosur SI edisi kesembilan, adalah sebagai berikut.. Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,022140 76 × 10 23.

Konsep Mol Kimia Lengkap Pengertian, Penjelasan, Istilah, Latihan Soal dan Pembahasannya
Dalam melakukan perhitungan yang berhubungan dengan senyawa kimia atau reaksi, mol adalah konsep yang selalu digunakan. Segala perhitungan kimia ini dilakukan menggunakan prinsip-prinsip tertentu yang telah ditentukan agar tercipta reaksi yang lebih efisien, lho .
5 Tahapan Reaksi Kimia kabarmedia.github.io
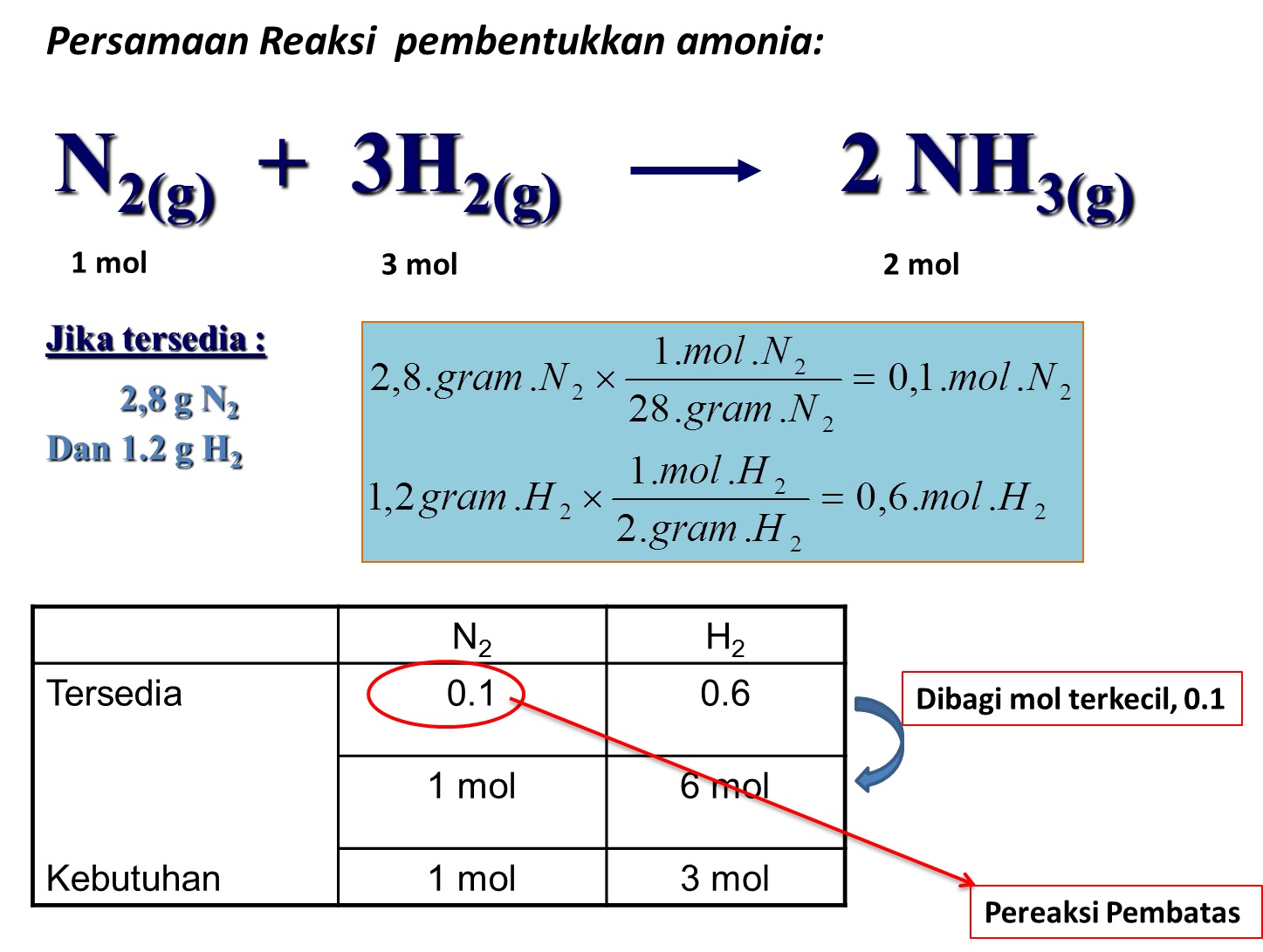
Rasio Mol: Definisi dan Contoh. Dalam reaksi kimia, senyawa bereaksi dalam rasio yang ditetapkan. Jika rasio tidak seimbang, akan ada sisa reaktan. Untuk memahami hal ini, Anda harus terbiasa dengan rasio molar atau. Satuan perbandingan mol adalah mol:mol atau bilangan tak berdimensi karena satuannya saling meniadakan.

Cara Mencari Rumus Molekul Unsur dan Senyawa Kimia Kelas 10 Belajar Gratis di Rumah Kapan
Untuk berpindah dari molekul ke mol, bagi jumlah molekul dengan 6,02 x 10 23 . Misalnya, jika Anda tahu ada 3,35 x 10 22 molekul air dalam satu gram air dan ingin mencari berapa mol air ini: mol air = molekul air / bilangan Avogadro. mol air = 3,35 x 10 22 / 6,02 x 10 23. mol air = 0,556 x 10 -1 atau 0,056 mol dalam 1 gram air.