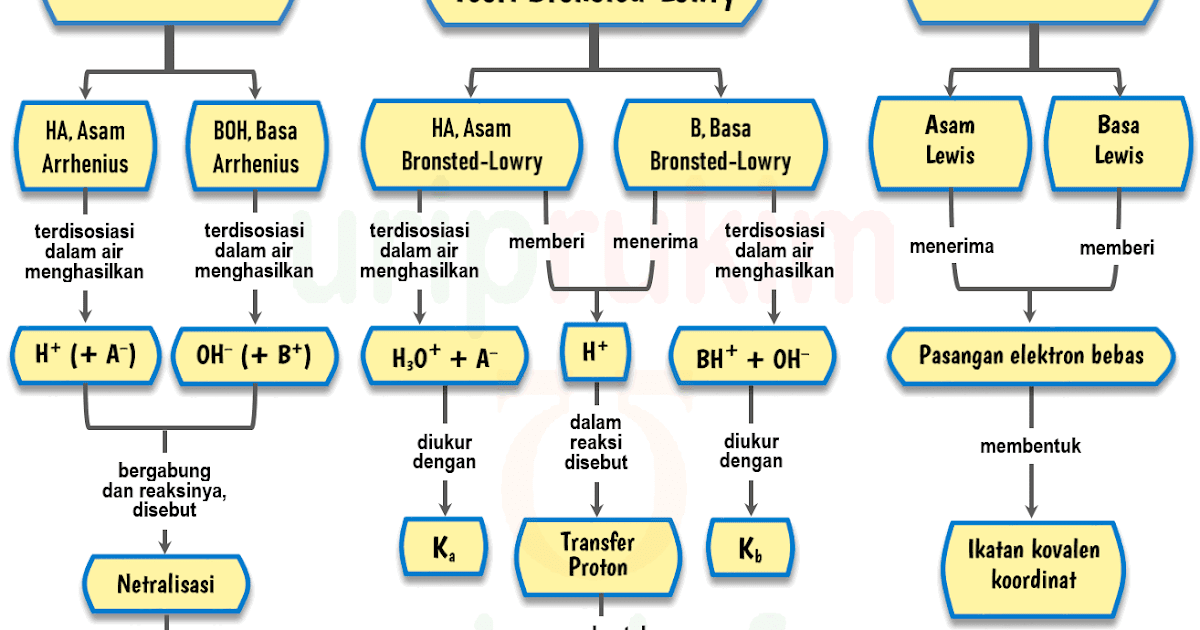
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Asam menurut teori Arrhenius adalah senyawa kimia yang terdiri dari ion hidrogen (H+) dan dapat menghasilkan ion hidronium (H3O+) dalam larutan air. Teori ini diperkenalkan oleh ahli kimia Swedia, Svante Arrhenius, pada akhir abad ke-19. Asam Arrhenius memiliki sifat korosif dan bersifat asam dalam larutan air, dengan kemampuan untuk membentuk garam dengan basa.

Teori Asam Basa
YSM Channel. 1 Sifat Sifat : Mengubah kertas lakmus biru menjadi merah Bereaksi dengan logam aktif menghasilkan garam dan gas Hidrogen (H2) Rasanya masam/asam Menghantarkan arus listrik Bereaksi dengan basa menghasilkan air dan senyawa garam ASAM merupakan donor proton [H+] Teori Asam Basa ARRHENIUS Asam adalah senyawa yang melepaskan H + dalam.
Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Qi et al. (2010) omega-3 dapat diperoleh dari . bahan makanan nabati. Dalam sebuah penelitian baru,. udang adalah asam glutamat, asam aspartat, arginin, lisin, leusin, glisin dan alanin.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
30 Agustus 2023. jelaskan pengertian asam dan basa menurut arrhenius -. Asam dan basa adalah salah satu konsep kimia yang paling dasar. Menurut teori Arrhenius, asam adalah suatu substansi yang dapat melepaskan ion hidrogen (H+) ke dalam larutan, sedangkan basa adalah suatu substansi yang dapat melepaskan ion hidroksida (OH-) ke dalam larutan.

Konsep Asam Basa kimia A. Konsep Asam Basa Teori Asam Basa a. Teori Arrhenius Menurut
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan basa adalah zat yang.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
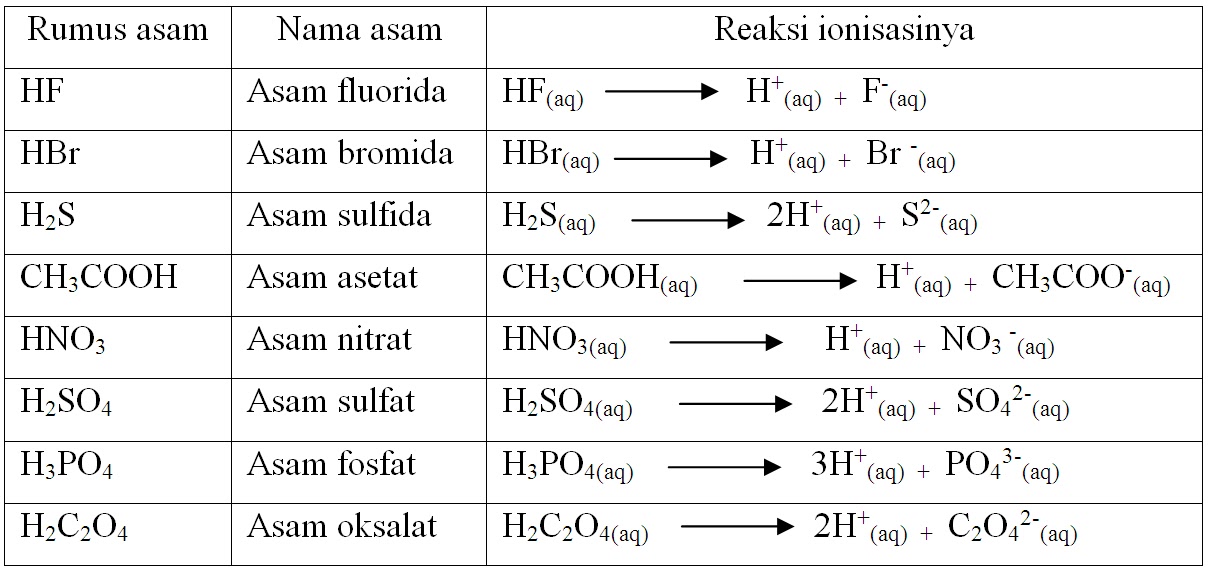
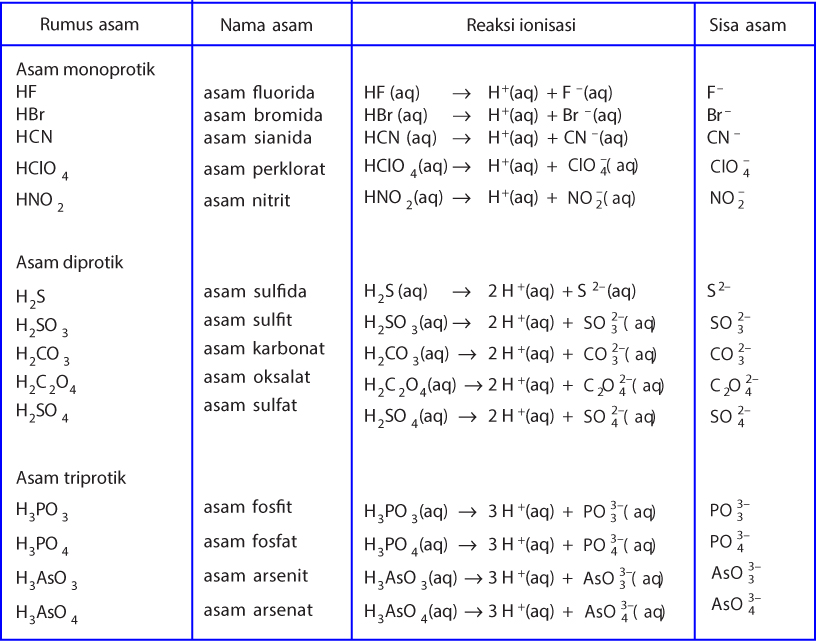
Menurut konsep Arrhenius, asam adalah zat yang dapat melepaskan ion hidrogen (H+) ketika dilarutkan dalam air. Ketika asam bereaksi dengan air, ion hidrogen akan dilepaskan sehingga larutan tersebut memiliki pH yang rendah. Contoh asam menurut konsep Arrhenius adalah asam sulfat (H2SO4) dan asam klorida (HCl)..

Bab 5 ASAM DAN BASA Menurut Arrhenius asam
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Pada tahun 1884, Svante August Arrhenius mengemukakan teori asam basa ini. Definisi asam basa menurut Arrhenius seperti ini: Asam adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion H +. Basa adalah senyawa yang apabila dilarutkan didalam air akan melepaskan ion OH -. Gas asam klorida (HCI) yang sangat larut didalam air.

Definisi Asam Menurut Arrhenius Adalah
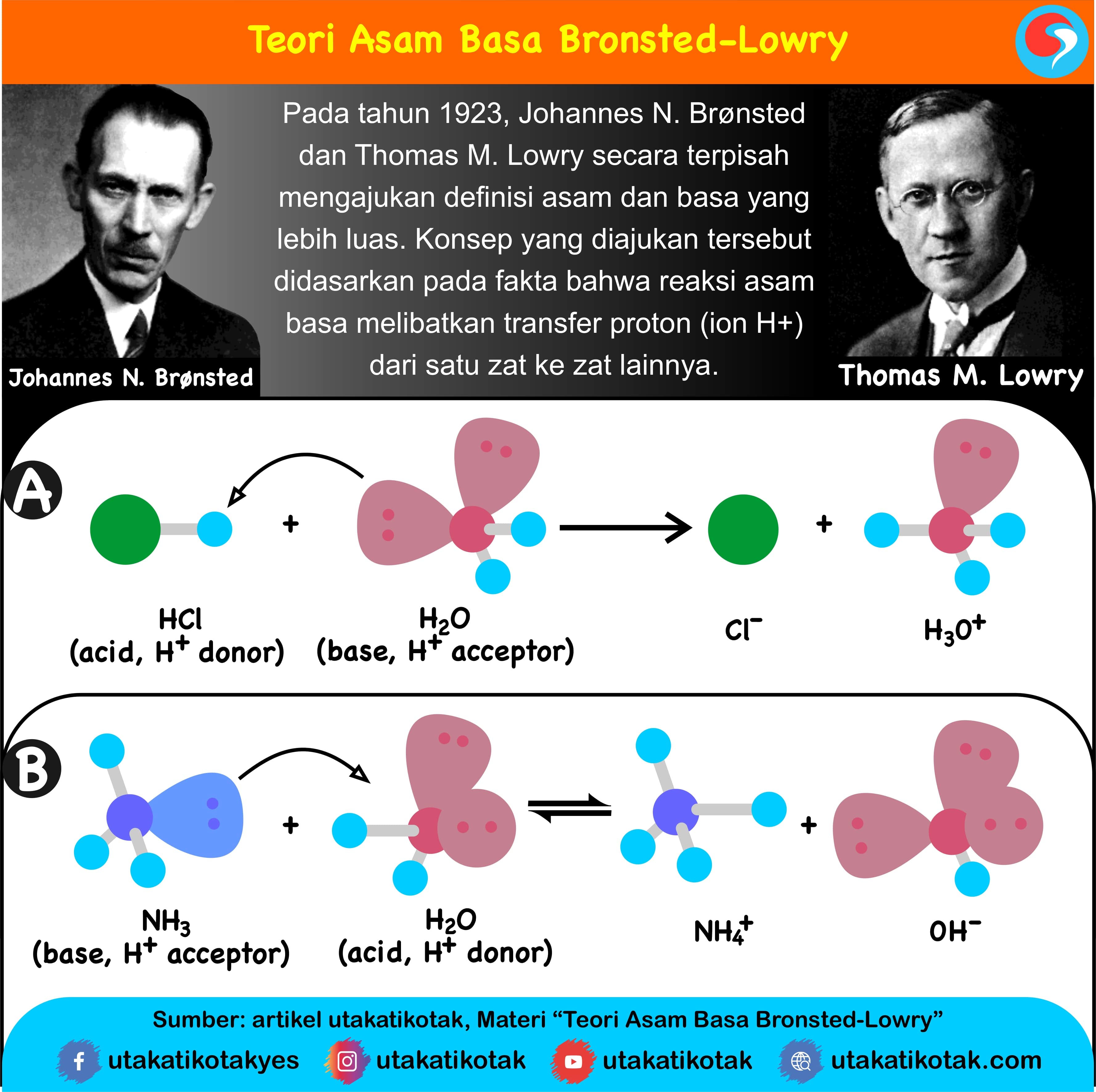
Arrhenius: Menurut definisi ini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H 3 O +) ketika dilarutkan dalam air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air. Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton kepada basa.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Pengertian asam Dikutip dari laman emodul Kemdikbud, pengertian asam menurut Svante August Arrhenius, seorang ahli kimia asal Swedia yang hidup tahun 1859-1927 adalah semua zat yang jika dilarutkan dalam air akan terurai menghasilkan ion H+. Misalnya hidrogen klorida (HCL) jika dilarutkan dalam air akan menjadi ion H+ dan ion Cl-.
Teori Asam Basa Arrhenius dan PH Larutan Asam Basa ( file swf ) Ilmu Fisika and Biologi
Menurut teori Arrhenius, asam adalah senyawa kimia yang dapat membebaskan ion hidrogen (H+) ketika larut dalam air. Teori ini dikemukakan oleh ahli kimia Swedia bernama Svante Arrhenius pada akhir abad ke-19. Konsep ini menjadi salah satu landasan utama dalam memahami sifat-sifat asam dan reaksi-reaksi kimia yang melibatkan asam.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Arrhenius, asam adalah senyawa yang menghasilkan ion dalam air, sedangkan basa senyawa yang menghasilkan ion dalam air. Perkembangan teori asam basa dimulai dari seorang tokoh bernama Svante Arrhenius (1859-1927). Beliau mengemukakan teori asam-basa untuk larutan dengan pelarut air. Asam didefinisikan sebagai senyawa yang terionisasi.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.

Menurut arrhenius asam adalah Amenoma
Menurut teori Arrhenius, asam adalah suatu senyawa kimia yang dapat menghasilkan ion hidrogen (H+) ketika larut dalam air. Contoh paling umum dari asam menurut teori Arrhenius adalah asam klorida (HCl) dan asam sulfat (H2SO4). Ketika larut dalam air, asam klorida akan memecah menjadi ion H+ dan ion klorida (Cl-), sedangkan asam sulfat akan.