
Teori Asam Basa
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Teori Arrhenius. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Menurut Arrhenius, asam adalah suatu senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidrogen (H+), sedangkan basa adalah senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidroksida (OH-).. Asam menurut Lewis adalah zat yang dapat menerima pasangan elektron dari zat lain, sedangkan basa adalah zat yang memiliki.
Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Salah satu teori yang digunakan untuk menjelaskan sifat asam adalah teori asam dan basa Arrhenius. Teori ini dikembangkan oleh seorang ahli kimia asal Swedia bernama Svante Arrhenius pada tahun 1884. Dalam teori ini, Arrhenius mengemukakan bahwa asam adalah zat yang dapat melepaskan ion hidrogen (H+) ketika larut dalam air.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
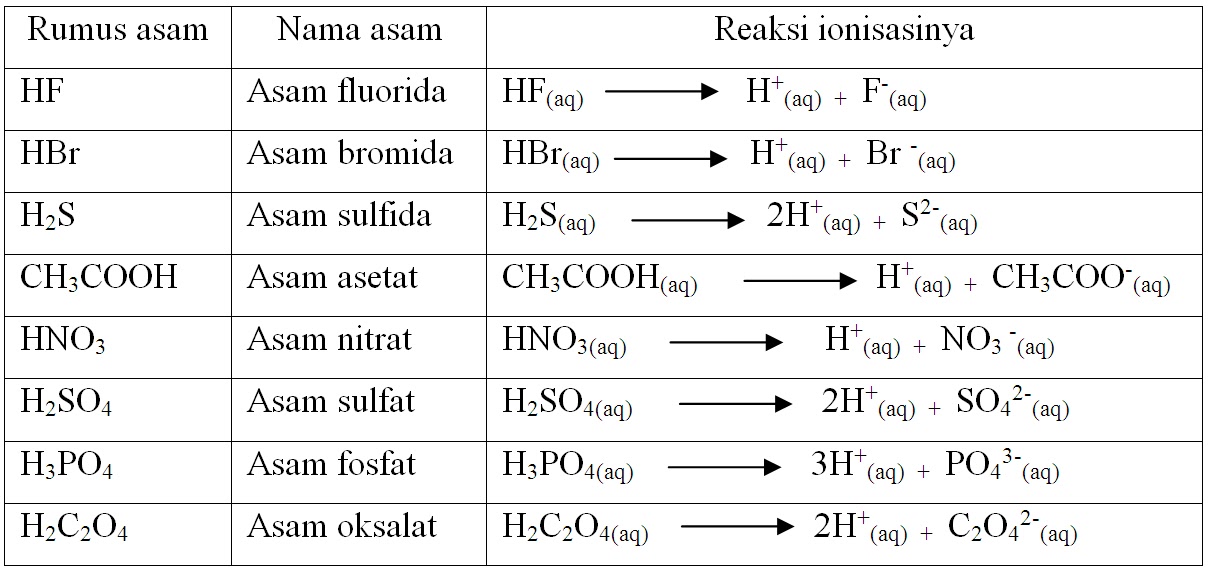
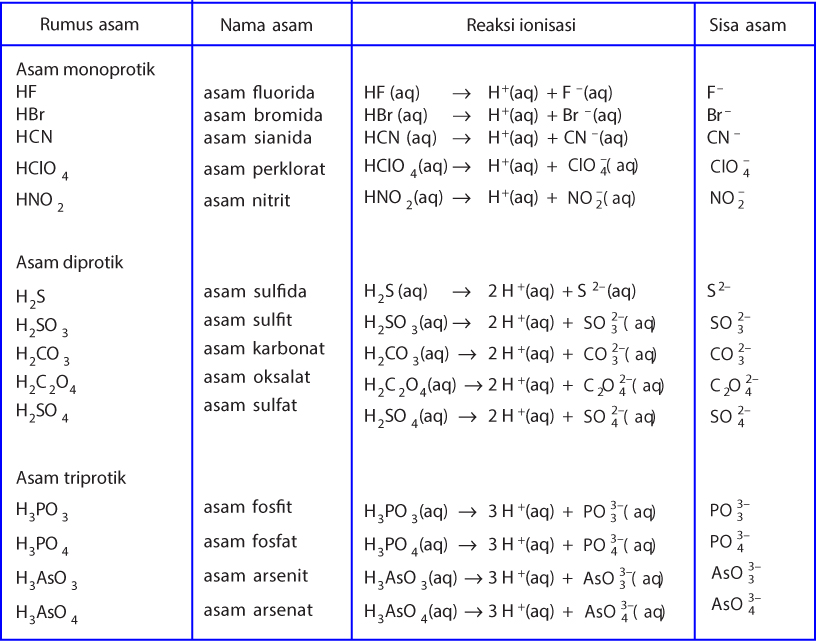
Menurut teori Arrhenius, asam Arrhenius merupakan zat yang jika dilarutkan dalam air, maka air tersebut akan menghasilkan ion H+ dalam larutan tersebut. Contohnya adalah ketika asam klorida atau HCI serta asam asetat atau CH3COOH dilarutkan, dengan persamaan reaksi yang terjadi dari asam klorida serta asam asetat sebagai berikut.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
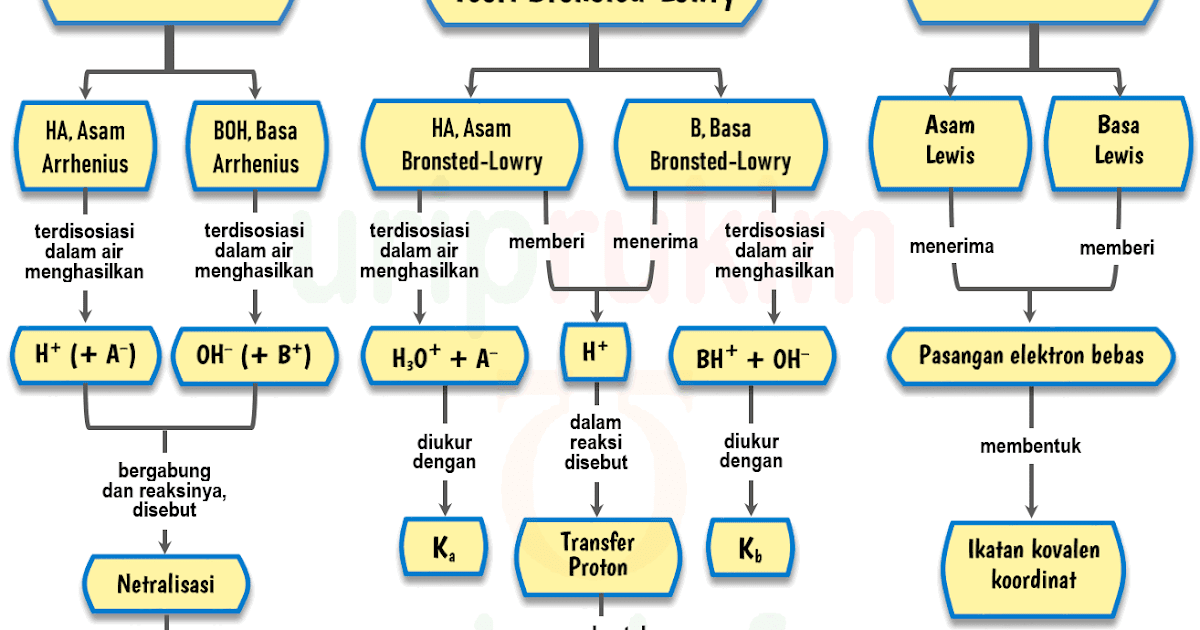
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.

Teori Asam Basa
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
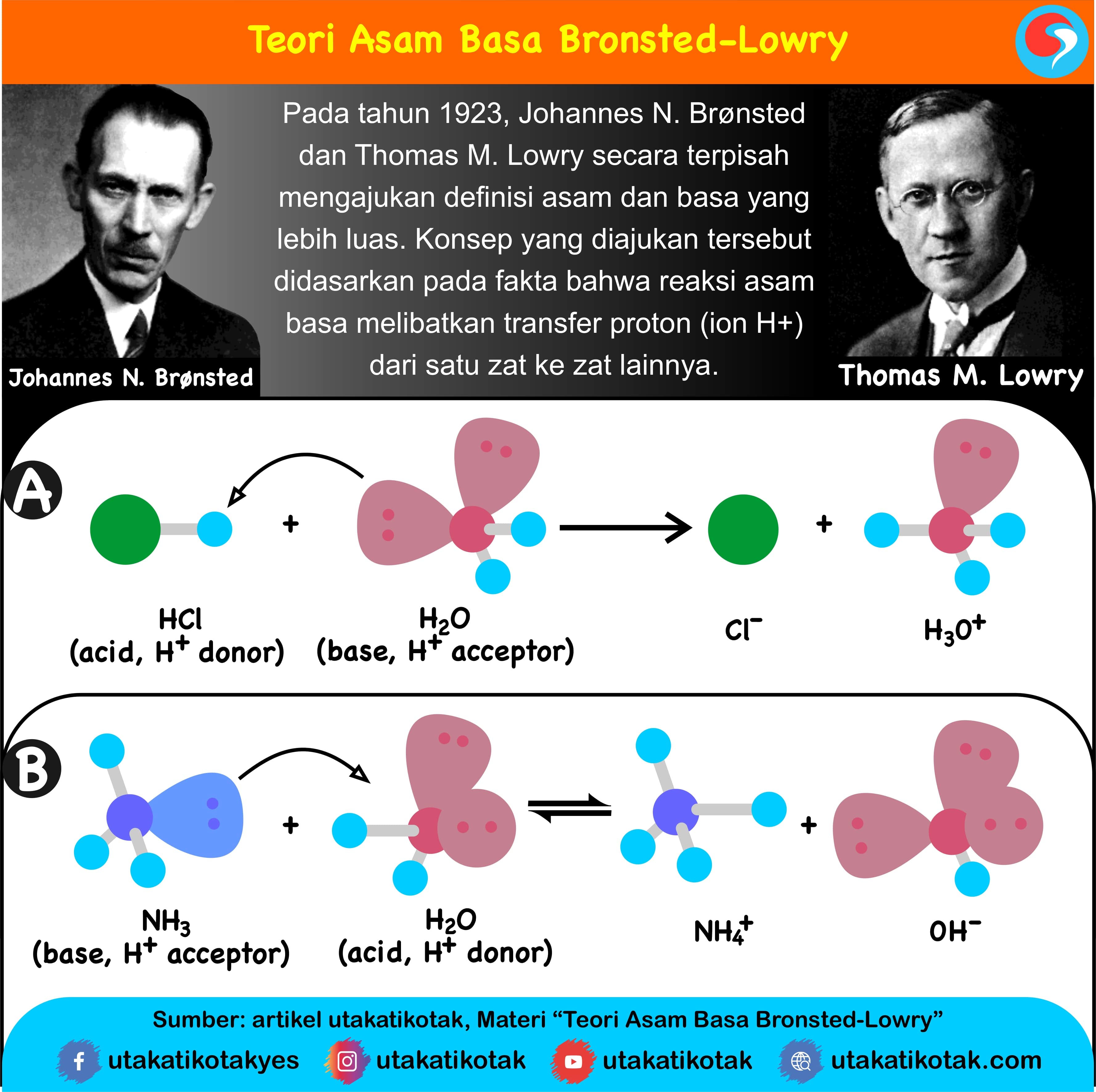
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Definisi Asam Menurut Arrhenius Adalah
Menurut Arrhenius, asam adalah zat yang dapat melepas ion dalam air. Sedangkan basa adalah zat yang dalam air melepas ion . Jadi, jawaban yang benar adalah B. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS! 12rb+ 4.9 (16 rating)

Asam Menurut Arrhenius Adalah Dunia Sosial
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Arrhenius: Menurut definisi ini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H 3 O +) ketika dilarutkan dalam air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air. Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton kepada basa.
Teori Asam Basa Arrhenius dan PH Larutan Asam Basa ( file swf ) Ilmu Fisika and Biologi
Menurut Arrhenius asam adalah senyawa yang meningkatkan konstentrasi H+ dalam larutan berair. Artinya, asam Arrhenius adalah senyawa yang menghasilkan ion hidrogen (H+). Ketika suatu zat dilarutkan dalam air. Jika zat tersebut menghasilkan ion H+, berarti zat tersebut adalah asam. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Pengertian Asam Menurut Arrhenius. Menurut konsep Arrhenius, asam adalah suatu senyawa kimia yang dapat menghasilkan ion hidrogen (H+) ketika larut dalam air. Dengan kata lain, asam adalah zat yang dapat melepaskan proton (H+) dalam larutannya. Contoh yang paling umum dari asam adalah asam klorida (HCl) dan asam sulfat (H2SO4).

Konsep Asam Basa kimia A. Konsep Asam Basa Teori Asam Basa a. Teori Arrhenius Menurut
Menurut Lewis, asam adalah zat yang menerima pasangan elektron. Sedangkan basa adalah zat yang menyumbangkan atau mendonasikan pasangan elektron.. Menurut Arrhenius, dalam penelitiannya, ketika asam yang merupakan suatu zat kemudian dimasukkan ke air akan menghasilkan suatu ion hydronium atau H+. Asam itu juga disebut dengan kovalen polar.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Larutan asam dan basa merupakan contoh dari larutan elektrolit. Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H +, sedangkan basa adalah zat yang dalam air melepaskan ion OH-.Jadi pembawa sifat asam adalah ion H +, sedangkan pembawa sifat basa adalah ion OH-.Asam Arrhenius dirumuskan sebagai H x Z, yang dalam air mengalami ionisasi sebagai berikut.

Menurut Arrhenius Asam Adalah Zat Yang Data Dikdasmen
Teori Asam Basa Arrhenius. Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan.