
Larutan Ha 0 1 M Lengkap
Sedangkan bahan yang digunakan adalah larutan HCl 0,1 M dan 1N, larutan H2SO4 0,1 M dan 1N, NaOH 0,1 N; 0,01 N; dan 0,001 N, aquades, kertas indicator pH, dan kertas lakmus merah dan lakmus biru. 3.3 Cara Kerja Adapun cara kerja dalam praktikum ini yaitu: 1. Disiapkan masing-masing larutan pada beaker glass. 2.

Hitung volume larutan HCl 0,1 M yang ditambahkan ke dalam...
Larutan asam klorida (HCl) 0,1 M dan larutan (H2SO4) 0,1 M dengan from www.masdayat.net Pengertian Asam Klorida. Asam klorida atau HCl adalah senyawa kimia yang memiliki sifat asam kuat. Senyawa ini memiliki rumus kimia HCl dan berupa gas yang tidak berwarna serta berbau tajam. Saat dilarutkan dalam air, gas HCl membentuk larutan asam klorida.

Normalitas (Standarisasi) HCl 0,05 N Dengan BBP Boraks (Na2B4O7 . 10 H2O)
Haiko friend pada saat ini Diketahui suatu larutan dibuat dengan mencampurkan 200 ml HCL 100 ml H2 so4 0,5 molar harga ph campuran tersebut adalah HCL merupakan ionisasi h2s merupakan asam kuat yang akan terionisasi menjadi 2 + + so4 2 minus isinya konsentrasi H plus campuran volume 1 dikali volume 2 bagai air yang kedua so4 volume campurannya adalah volumenya 200 volume 120 / 300 hasilnya.

Larutan HCl 0,1 M sebanyak 100 mL dicampurkan dengan
Sedangkan bahan yang digunakan adalah larutan HCl 0,1 M dan 1N, larutan H2SO4 0,1 M dan 1N, NaOH 0,1 N; 0,01 N; dan 0,001 N, aquades, kertas indicator pH, dan kertas lakmus merah dan lakmus biru. 3.3 Cara Kerja Adapun cara kerja dalam praktikum ini yaitu: 1. Disiapkan masing-masing larutan pada beaker glass. 2.

Molalitas dari 100 mL larutan H2SO4 5 M adalah (Mr H2SO4
Larutan asam klorida HCl 0,1 M dan larutan H 2 SO 4 0,1 M dengan volume yang sama dicampur menjadi satu. Hitunglah pH campuranlarutan tersebut!

Dari hasil titrasi larutan NaOH 0,1 M dengan larutan HCl
Kalau pengen di sini ada soal kita punya dua larutan yang dicampur menjadi satu yaitu HCL 0,1 molar dan H2 so4 0,1 molar juga dengan volume yang sama kita asumsikan volumenya masing-masing 1 liter kemudian berapa ph campurannya pakai untuk mengerjakan soal ini perlu kita ingat itu merupakan derajat keasaman suatu larutan PH dapat dicari dengan dua cara yang pertama jika larutan asam maka bisa.

Jual Larutan Naoh Larutan Natrium Hidroksida N Normalitas My XXX Hot Girl
Sebagai contoh, 40 mL larutan HCl 0,1 M ditetesi dengan larutan NaOH 0,1 M sedikit demi sedikit. Berikut kurva titrasi yang menggambarkan perubahan pH selama titrasi tersebut.. V A, V B = volum larutan asam A dan basa B. Jika valensi dari asam A dan basa B yang bereaksi diketahui, konsentrasi larutan asam/basa juga dapat dicari dengan rumus.
[Sulfuric Acid solution (H2SO4) 황산용액 0.1M/1M 화)450㎖ ]
Pembahasan. Senyawa HCl merupakan asam kuat monovalen atau valensi asam (jumlah ) nya = 1. pH 10 mL larutan HCl 0,1 M sebelum diencerkan yaitu : Konsentrasi HCl setelah diencerkan menjadi 100 mL yaitu : pH larutan HCl setelah diencerkan yaitu : Jadi, pH larutan HCl sebelum diencerkan adalah 1 dan setelah pengenceran berubah menjadi 2.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
N1.V1=N2.V2. 36.V1=1.1000. V1=1000.1/36. V1=27,8 ml. Jadi asam sulfat pekat yang dibutuhkan sebanyak 27,8 ml. Sehingga cara pembuatan asam sulfat ( H2SO4 ) 1 N sebanyak 1000 ml adalah : Isi labu takar ukuran 1 liter dengan aquadest kira-kira 250 ml, lalu tambahkan 27,8 ml asam sulfat pekat secara perlahan.
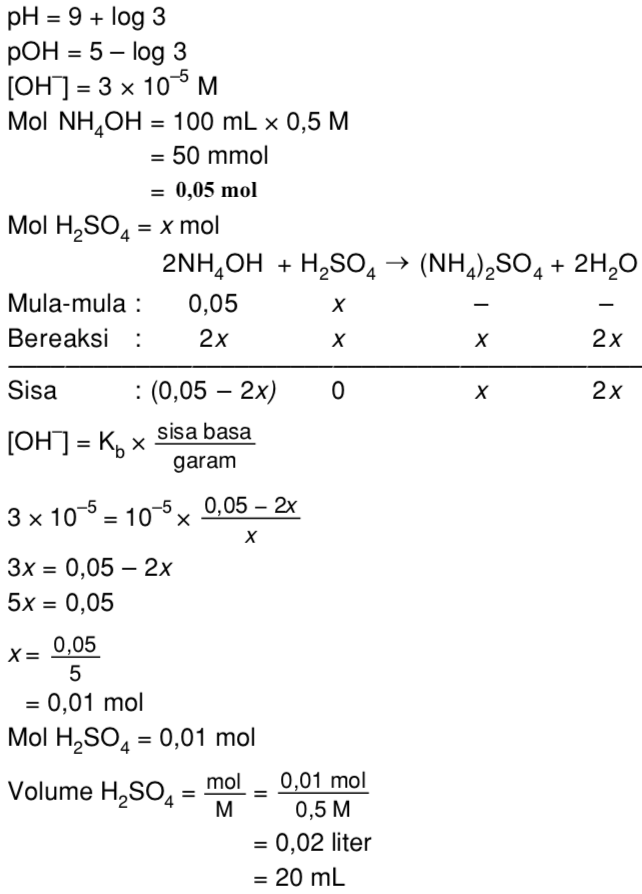
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Pelajari tentang larutan HCl 0,1M dan larutan H2SO4 yang telah menjadi topik penting dalam dunia kimia. Dalam artikel ini, Anda akan mengetahui sifat, penggunaan, kelebihan, dan kelemahan masing-masing larutan. Pelajari bagaimana pengaruh larutan ini terhadap zat lain dan bagaimana mereka mampu meningkatkan kinerja reaksi kimia. Baca artikel lengkapnya di sini.

April 2015 JAGAD KIMIA
Contoh Soal Derajat Keasaman Larutan dan Jawaban. Berikut ini adalah contoh soal tentang materi derajat keasaman dalam larutan: 1. Hitunglah pH larutan asam sulfat 0.05 M. Jawab: Asam sulfat (H2SO4) adalah asam kuat bervalensi 2. [H+] = Ma x a. = 0.05 x 2. = 0.1 mol/L.

Sebanyak 50 mL larutan NaOH 1 M direaksikan dengan 100 mL larutan HCl 1 M, maka pH larutan
Larutan asam klorida HCl 0,1 M memiliki berbagai penggunaan dan manfaat di laboratorium, di antaranya: Sebagai bahan kimia dalam sintesis organik dan anorganik. Sebagai bahan kimia dalam analisis kualitatif dan kuantitatif, seperti dalam analisis sisa. Sebagai bahan kimia dalam produksi pupuk, makanan, dan minuman.

Berikut data hasil titrasi larutan HCl dengan larutan
Dimana a = jumlah H + dan Ma = Molaritas asam. Jadi, [H +] = 2 x 0,1 = 0,2 atau 2 x 10-1. pH = -log[H +] = -log. Larutan HA 0,1 M akan memberikan warna yang sama dengan larutan HCl 0,001 M jika ditetesi dengan indikator universal. Hitunglah nilai K a HA. 306. 4.6.

50 mL larutan H2SO4 0,1 M direaksikan dengan 50 mL NH4OH
Berapa pH larutan yang terbentuk bila sebanyak 0,0600 mol NaOH ditambahkan ke dalam 1 L larutan HCl 0,0500 M. A. 3,45 B. 8,90 C. 12,00. Pembahasan dan jawaban: Volume larutan 500 mL = 0,5 L. M = 23,4 = 23,4 = 0,8 M. Volume uap air yang dapat ditambahkan pada 250 mL larutan H2SO4 0,3 M untuk mendapatkan larutan H2SO4 dengan konsentrasi 0,1.

100 mL larutan HCl 0,1 M dicampurkan dengan 50 mL larutan...
V1 = 0,1 . 100 0,1 𝑥 100 V1 = = 0,82 ml 12,06 Mengambil HCl sedikit demi sedikit dengan pipet ukur dan memasukkannya ke dalam labu ukur Menambahkan aquades sedikit demi sedikit ke dalam labu ukur hingga mencapai 100 ml dengan tetap memperhatikan meniskus bawah Menutup labu ukur dengan penutup Menghomogenkan 100 ml larutan HCl 0,1 M dari.

Larutan NH4OH 0,1 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4, Mas Soal
kita memiliki campuran 50 ml HCL dengan konsentrasi 0,1 molar akan dinetralkan oleh larutan dengan berapa ML itu dengan mengalikan molaritas kali dengan volume hasil reaksi antara HCL menghasilkan NaCl + H2O adalah 1 banding 1 makacara sederhana kita bisa mengatakan bahwa 5 mili mol HCL itu dapat dinetralkan dengan 5 mili mol NaOH Kemudian yang kedua Mari kita H2 so4 dengan di mana jika kita.