
Konfigurasi elektron Penjelasan Tabel konfigurasi elektron
Pengertian Konfigurasi Elektron. Konfigurasi elektron adalah susunan elektron di dalam atom. Sejatinya, elektron merupakan partikel bermuatan negatif yang berputar mengitari inti atom. Gambaran mudahnya, inti atom dianalogikan sebagai Matahari. Nah, elektron dianalogikan sebagai planet-planet yang berputar mengelilingi Matahari tersebut.

Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
Konfigurasi Elektron dari 37 Rb =? Konfigurasi tanpa Gas Mulia 37 Rb = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 Konfigurasi dengan Gas Mulia 37 Rb = [Kr] 5s 1. 5. Penyingkatan menggunakan [Xe] apabila atom memiliki 54 < nomor atom < 86 kemudian dilanjutkan dengan kulit selanjutnya yaitu 6s, 4f, 5d dan 6p sesuai dengan jumlah elektron.

Konfigurasi Elektron Pengertian Aturan Contoh Soal Dan Riset
Intrium - Yttrium (39-Y) - Tabel Periodik - Unsur Kimia →. Massa Atom Relatif 85,4678 Bilangan Oksidasi 1 Konfigurasi Elektron [Kr]5s1 Titik Didih 961 K Titik Lebur 312,63 K Massa Jenis 1,532 g/cm3 Struktur Kristal bcc Elektronegativitas 0,82 Radius Atom 2,48 Aº Volume Atom 55,9 cm3/mol Radius Kovalensi 2,16 Aº Entalpi Penguapan 69,2.
Pengertian Konfigurasi Elektron Rumus Kimia
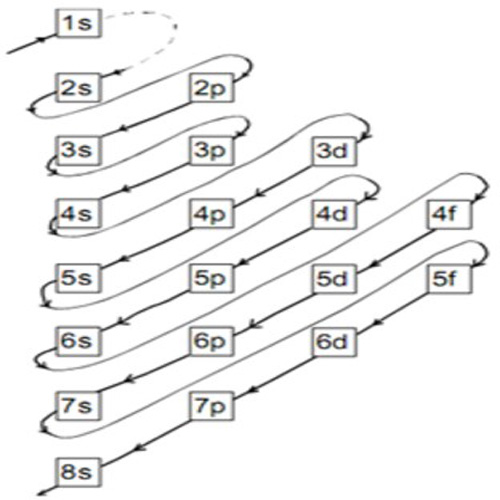
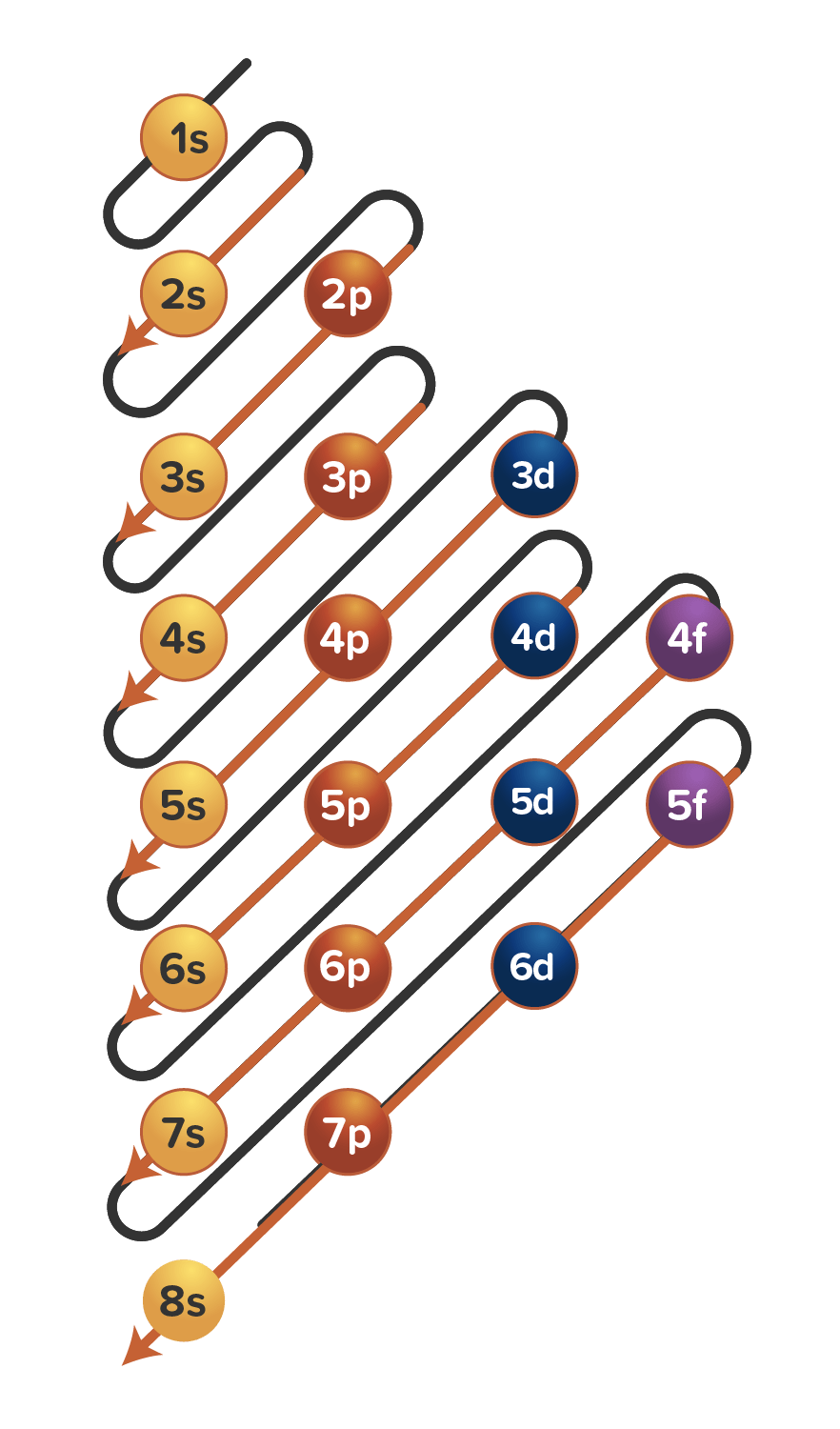
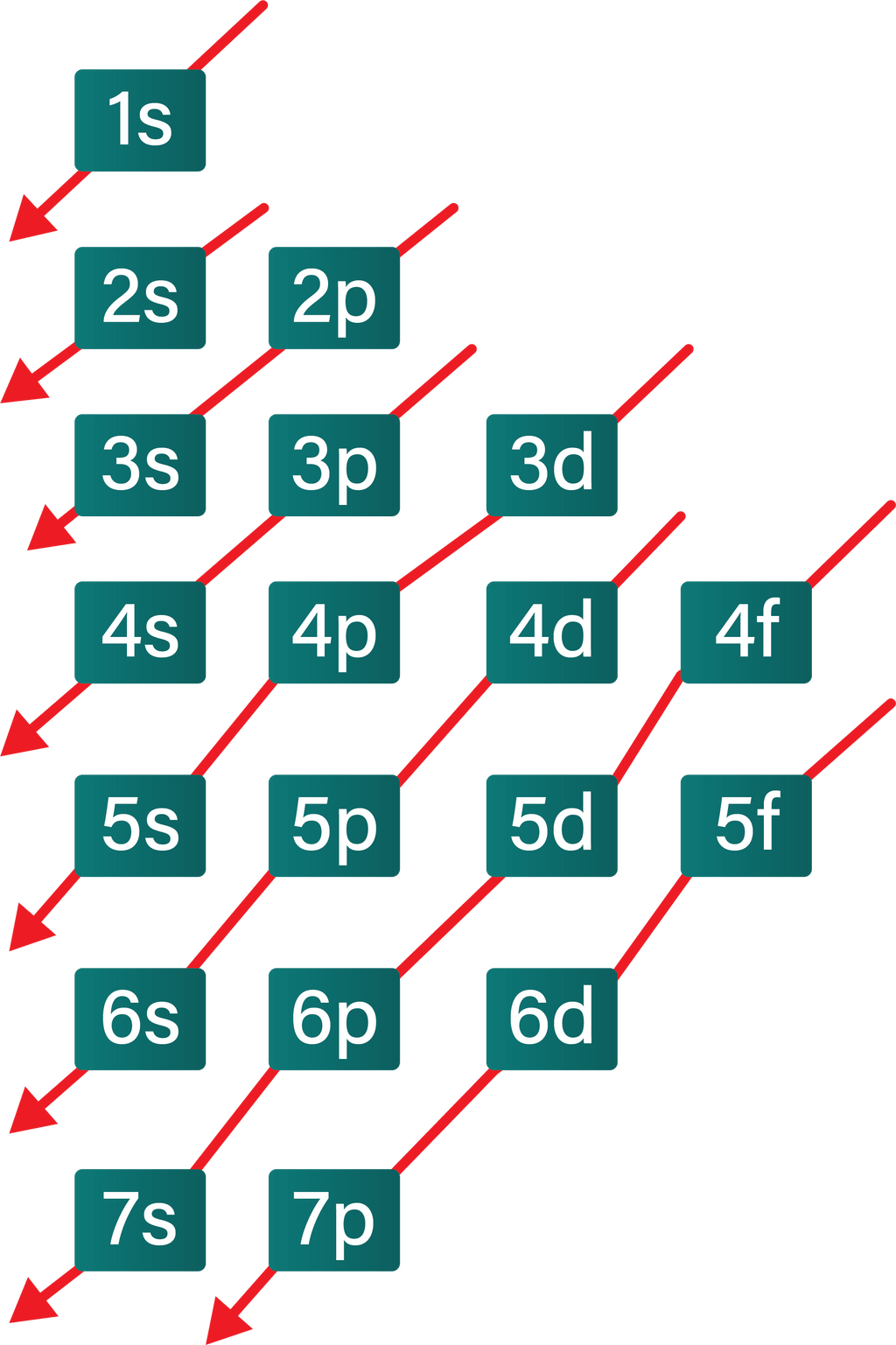
Aturan penentuan konfigurasi elektron berdasarkan orbital: 1. Asas Aufbau: Elektron menempati orbital-orbital dimulai dari tingkat energi yang terendah, dimulai dari 1s, 2s, 2p, dan seterusnya seperti urutan subkulit yang terlihat pada Gambar 2. Gambar 2. Urutan tingkat energi subkulit.
KIMIA "Konfigurasi elektron"
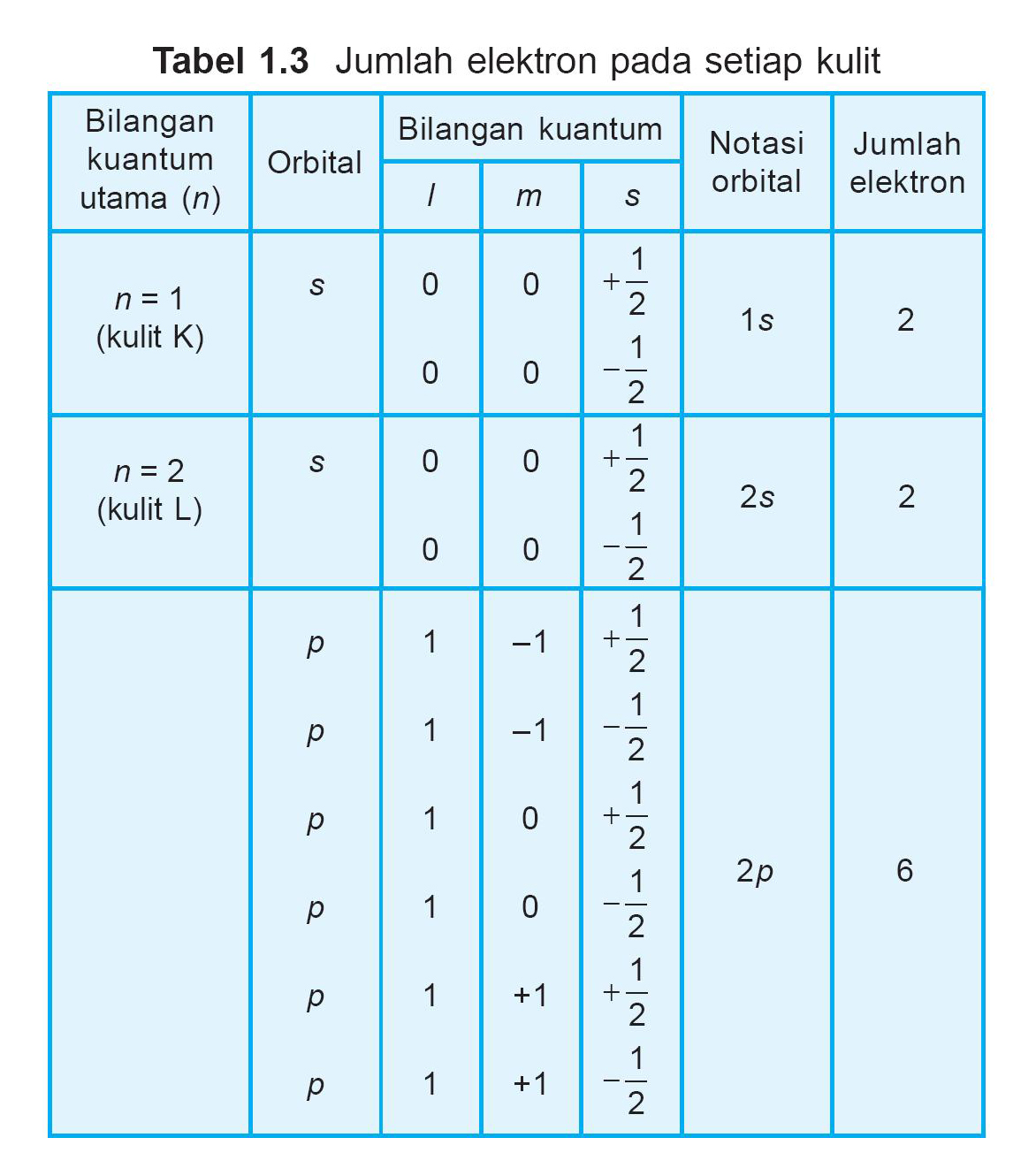
Konfigurasi elektron yang pertama kali dipikirkan adalah berdasarkan pada model atom model Bohr. Adalah umum membicarakan kelopak maupun subkelopak walaupun sudah terdapat kemajuan dalam pemahaman sifat-sifat mekanika kuantum elektron. Berdasarkan asas larangan Pauli, sebuah orbital hanya dapat menampung maksimal dua elektron.

KONFIGURASI ELEKTRON TEORI ATOM BOHR YouTube
Rubidium. Rb. German chemists Robert Bunsen and Gustav Kirchhoff discovered rubidium in 1861 by the newly developed method of flame spectroscopy. The separation of the metal was tried by Bunsen, but he never got samples with more than 18% of Rubidium. The separation of the metal was only accomplished by George de Hevesy, through the hydrolysis.
Tentukan konfigurasi elektron dari atom berikut!
Konfigurasi elektron Dalam fisika atom dan kimia kuantum, konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur fisik lainnya. Sama seperti partikel elementer lainnya, elektron patuh pada hukum mekanika kuantum dan menampilkan sifat-sifat bak-partikel maupun bak-gelombang. Secara formal, keadaan kuantum elektron tertentu ditentukan oleh fungsi.

Materi Konfigurasi Elektron Homecare24
Unsur-unsur tersebut di susun berdasarkan nomor atom yaitu jumlah proton dalam inti atom, konfigurasi elektron, dan keberulangan sifat kimia. Tabel periodik ini fungsinya adalah untuk mengetahui nomor atom, konfigurasi elektron, dan sifat setiap unsur.. Rubidium Rb 37: 84: Ruthenium Ru 44: 85: Rutherfordium Rf 104: 86: Samarium Sm 62: 87.

Cara Menentukan Konfigurasi Elektron
KOMPAS.com - Model atom mekanika kuantum menyatakan bahwa elektron berada pada orbital-orbital atom.. Atom-atom tersebut menempati orbital sesuai dengan susunannya, atau yang disebut sebagai konfigurasi elektron.. Aturan dalam konfigurasi elektron terdiri dari tiga yakni Prinsip Aufbau, Aturan Hund, dan Larangan Pauli.. Prinsip Aufbau. Dilansir dari Encyclopaedia Britannica, Prinsip Aufbau.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Konfigurasi elektron yang berakhiran pada subkulit berlaku aturan penuh setengah penuh. Aturan ini menyatakan bahwa, suatu elektron mempunyai kecenderungan berpindah orbital apabila dapat membentuk susunan elektron yang lebih stabil. Itu tadi penjelasan mengenai konfigurasi elektron beserta cara menentukanya. Selamat belajar ya detikers!
Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
The rubidium atom donates an electron of the last shell to form bonds and turns into a rubidium ion (Rb + ). That is, rubidium is a cation element. Rb - e - → Rb +. The electron configuration of rubidium ion (Rb +) is 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6.

Kimia Kelas X Konfigurasi Elektron berdasarkan asas auffbau. YouTube
Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah.. Rubidium (Rb) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1: 38: Stronsium (Sr) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2: 39: Yttrium (Y) 1s.

Penjelasan Konfigurasi Elektron Secara Lengkap
Rb+ Electron Configuration (Rubidium Ion)In this video we will write the electron configuration for Rb+, the Rubidium ion. We'll also look at why Rubidium fo.

Cara menulis konfigurasi elektron dan mengisi diagram orbital YouTube
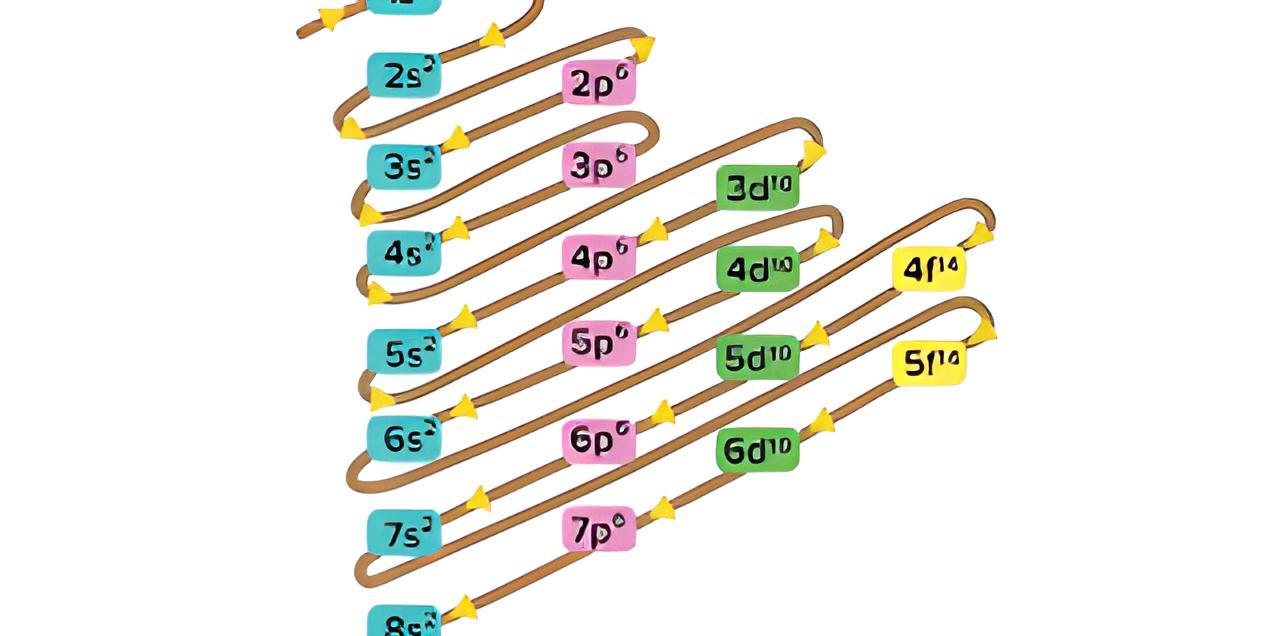
Penulisan konfigurasi elektron Aufbau dapat pula disingkat dengan menggunakan unsur gas mulia yang memiliki nomor atom paling mendekati dan tidak melebihi atom tersebut. Konfigurasi elektron 37 Rb dan 54 Xe. 37 Rb = 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 1 atau 37 Rb = [Kr] 5 s 1. 54 Xe = 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10.
Konfigurasi Elektron Pengertian, Cara Menentukan, & Contoh Soal
Elektron valensi menunjukkan golongan unsur dalam sistem periodik, sedangkan jumlah kulit menyatakan letak periode unsur tersebut dalam sistem periodik. Untuk dapat menjawab pertanyaan di atas, maka terlebih dahulu perlu dibuat konfigurasi elektron dari atom 37 Rb dengan menggunakan konfigurasi elektron menurut Bohr sebagai berikut. 37 Rb = 2.
Unsur 19 39 K mempunyai konfigurasi elektron
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.