
Keelektronegatifan / Elektronegatifitas Suatu Unsur Adalah Sifat Yang Menyatakan tujuan dari
Definisi Keelektronegatifan yaitu kecenderungan suatu unsur untuk menarik eleektron sehingga bermuatan negatif. Nah dalam sebuah Sistem Periodik Unsur terdafat sifat keperiodikan atau ciri khas perubahan nilai keelektronegatifan unsur, berikut ini adalah Sifat-Sifat Keperiodikan Unsur terhadap Keelektronegatifan

Keelektronegatifan unsur dalam satu periodekimia sma YouTube
Pengertian Keelektronegatifan adalah sebuah konsep yang digunakan dalam kimia untuk menggambarkan kemampuan suatu atom dalam menarik elektron pada suatu ikatan kimia. Konsep ini pertama kali diperkenalkan oleh Linus Pauling pada tahun 1932 dan menjadi salah satu konsep penting dalam memahami sifat-sifat kimia suatu senyawa. Dalam.

Diketahui keelektronegatifan unsur H, Cl, F dan Br secara berturutturut yaitu 2,1; 2,0; 4,0; 2
Cara Menghitung Elektronegativitas. Dalam kimia, elektronegativitas adalah pengukuran tingkat kekuatan suatu atom menarik elektron dalam suatu ikatan. [1] Atom dengan elektronegativitas yang tinggi menarik elektron dengan kuat, sedangkan atom dengan elektronegativitas yang rendah menarik elektron dengan lemah.

Keelektronegatifan suatu unsur adalah sifat yang menyatak...
Sedangkan, keelektronegatifan adalah kemampuan atom menarik elektron. Artinya, energi ionisasi dan keelektronegatifan adalah kebalikan. Dilansir dari Thought Co, atom dengan energi ionisasi yang rendah memiliki keelektronegatifan yang rendah juga karena inti atomnya tidak memberikan gaya tarik menarik yang kuat terhadap elektron.

Data keelektronegatifan beberapa unsur H=2,1;F=4,0;Cl=3...
Keelektronegatifan adalah ukuran kemampuan suatu atom untuk menarik elektron luarnya,atau elektron valensi. Karena elektron luar dari atom yang digunakan untuk ikatan, maka keeleketronegatifan berguna dalam meramalkan dan menerangkan kereaktifan kimia. Seperti jari-jari atom, keelektronegatifan dipengaruhi oleh jumlah proton dalam inti dan.

PPT IKATAN KIMIA PowerPoint Presentation, free download ID6053258
Pembahasan. Keelektronegatifan adalah kemampuan atau kecenderungan suatu atom untuk menangkap atau menarik elektron dari atom lain. Misalnya, fluorin memiliki kecenderungan menarik elektron lebih kuat daripada hidrogen. Jadi, dapat disimpulkan bahwa keelektronegatifan fluorin lebih besar daripada hidrogen. Konsep keelektronegatifan ini pertama.

senyawa polar keelektronegatifan, ikatan kimia, UN kimia 2016 pembahasan 03 YouTube
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika atomatom tersebut membentuk ikatan. Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 sampai 4. Yang mana, unsur yang mempunyai harga keelektronegatifan besar, cenderung menerima elektron dan akan membentuk ion.

Keelektronegatifan / Elektronegatifitas Suatu Unsur Adalah Sifat Yang Menyatakan tujuan dari
Keelektronegatifan suatu atom dipengaruhi oleh ukuran atom. Makin besar suatu atom, maka makin rendah keelektronegatifannya. Hal tersebut dikarenakan partikel yang bisa menarik elektron dalam suatu atom adalah proton yang bermuatan positif. Namun, proton berada di dalam inti atom (bagian tengah atom). Jika suatu atom berukuran besar, atom.

PPT IKATAN KIMIA PowerPoint Presentation, free download ID6053258
Keelektronegatifan adalah kemampuan suatu atom untuk menarik atom dari elektron lain mendekat ke arahnya. Nilai keelektronegatifan suatu atom dapat diketahui dengan melihat tabel periodik. Semakin ke kanan letak suatu atom pada tabel periodik, maka akan semakin besar pula nilai keelektronegatifan atom tersebut.

Diketahui data keelektronegatifan unsurunsur sebagai ber...
Fluor adalah unsur yang paling elektronegatif dan sesium adalah unsur yang paling elektronegatif. Tabel Keelektronegatifan. Elektronegativitas adalah sifat kimia yang menggambarkan kekuatan atom dalam molekul untuk menarik elektron ke dirinya sendiri. Ada perbedaan besar dalam keelektronegatifan untuk atom dari sisi kiri dan kanan tabel periodik.

Keelektronegatifan Terbesar YouTube
Keelektronegatifan adalah konsep penting dalam kimia yang menggambarkan kemampuan suatu atom dalam menarik pasangan elektron dalam ikatan kimia. Konsep ini diperkenalkan oleh ilmuwan Linus Pauling pada tahun 1932 dan membantu kita memahami sifat ikatan kimia, kestabilan senyawa, dan polaritas molekul. Dalam artikel ini, kita akan menjelajahi.
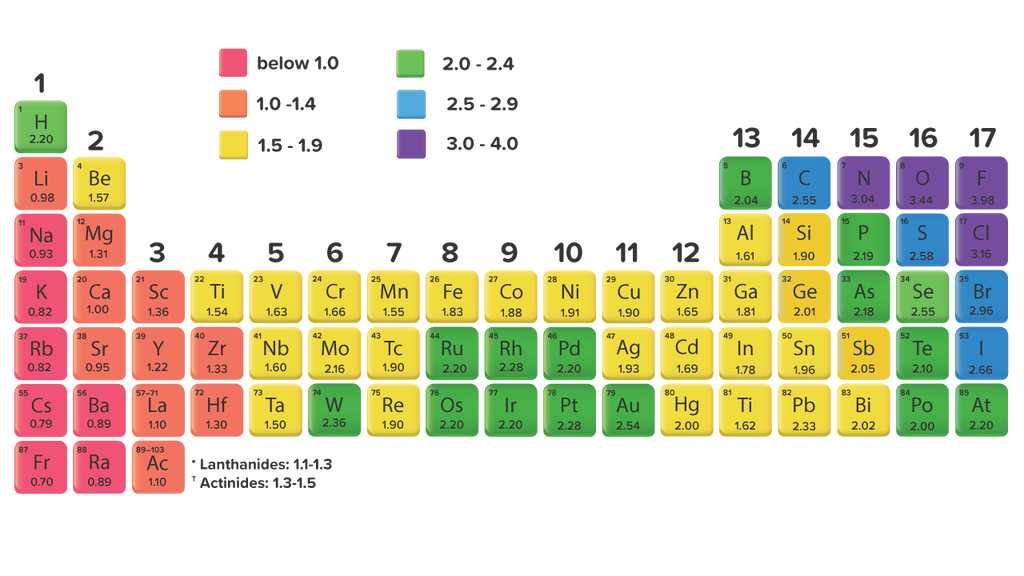
Unsur yang memiliki keeletronegatifan paling tingg...
Keelektronegatifan adalah salah satu tren tabel periodik. Cara umum untuk mengukur keelektronegatifan adalah dengan menggunakan skala Pauling. Linus Pauling adalah seorang ilmuwan Amerika yang memenangkan Hadiah Nobel untukkimia dan perdamaian. Skala keelektronegatifan Pauling dapat dilihat pada Gambar 1 juga. Gambar 1.

Data harga keelektronegatifan unsurunsur dalam satu peri...
Sebagai contoh, dalam golongan unsur halogen. Fluor adalah unsur paling atas dan memiliki keelektronegatifan paling besar dengan skala Pauling bernilai 4. Adapun, makin ke bawah golongan halogen maka makin rendah keelektronegatifannya. Astatin yang berada paling bawah unsur halogen memiliki keelektronegatifan paling rendah dalam golongannya.

Cara Mudah Menjawab Soal Keelektronegatifan (Kimia SBMPTN, UN, SMA) YouTube
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen. [1] Konsep elektronegativitas pertama kali oleh Linus Pauling pada tahun 1932 sebagai.

Trik Super Kilat Memahami Keelektronegatifan
Keelektronegatifan adalah salah satu konsep penting dalam kimia yang membahas kemampuan suatu atom menarik pasangan elektron dalam ikatan kimia. Dalam artikel ini, kita akan membahas pengertian keelektronegatifan, skala keelektronegatifan, serta menjawab beberapa pertanyaan umum yang sering diajukan tentang keelektronegatifan.

Jelaskan Energi Ionisasi dan Keelektronegatifan? Fisika Kimia
Keelektronegatifan Pauling, tanpa diragukan lagi, adalah skala yang paling luas dan digunakan, terutama dalam kursus kimia dasar atau kimia umum. Pada skala ini, nilai sewenang-wenang 4,0 ditetapkan untuk keelektronegatifan unsur paling elektronegatif dalam tabel periodik, fluor, dan nilai lainnya ditetapkan berdasarkan nilai referensi tersebut.