
Firstwisnu Media Kenaikan Titik Didih Dan Penurunan Titik Beku Larutan Reverasite
satu gram MgCl2 dilarutkan dalam 500 gram air . tentukanlah titik didih, titik beku dan tekanan osmotik larutan itu pada 25C jika derajat ionisasi 0,9. sifa.

Perhatikan tabel data titik leleh dan titik didih beberap...
📚 Soal Kimia : Kelas 12 (XII) - SIFAT KOLIGATIF LARUTAN📝 Hitunglah titik didih dan titik beku laruan glikol 20% berdasarkan massa. (Mr glikol = 62 g/mol; K.

Hitunglah titik didih dan titik beku larutan glikol 20 berdasarkan massa. (Mr glukosa = 62 Kb
Pembahasan. Untuk mengetahui titik didih dan titik beku larutan perlu dicari terlebih dahulu molalitas larutan. Glikol 20% artinya, dalam 100% larutan, 20%-nya adalah glikol, sementara sisanya adalah pelarut. Jika dimisalkan 100% larutan adalah 100 gram, maka 20 gram-nya adalah glikol, dan 80 gram-nya adalah pelarut. Maka, dapat dicari molalitas:
Hitunglah titik didih dan titik beku larutan gliko...
1. Puerto de Mogán beach, one of the best things to do in Puerto de Mogán. It is a small beach about 200 meters long and with numerous services. For example, it is one of the accessible beaches of Gran Canaria. In other words, it is suitable for people with reduced mobility and, therefore, easily accessible for prams.

Hitunglah tekanan uap, titik didih, dan titik beku larutan glukosa 36 dalam air pada suhu 25
Contoh soal penurunan titik beku & kenaikan titik didih Hitunglah titik didih dan titik beku larutan glikol 20% berdasar massa. (Mr glikol = 62; Kb dan Kf berturut-turut adalah 0,52 o C/m dan 1,86 o C/m) PEMBAHASAN : Menghitung molalitas terlebih dahulu Menentukan titik beku glikol ΔT f = K f.m ΔT f = 1,86. 4,03 ΔT f = 7,49 T f o-T f l = 7.

SOAL LATIHAN KIMIA TITIK BEKU DAN TITIK DIDH Rozezisme
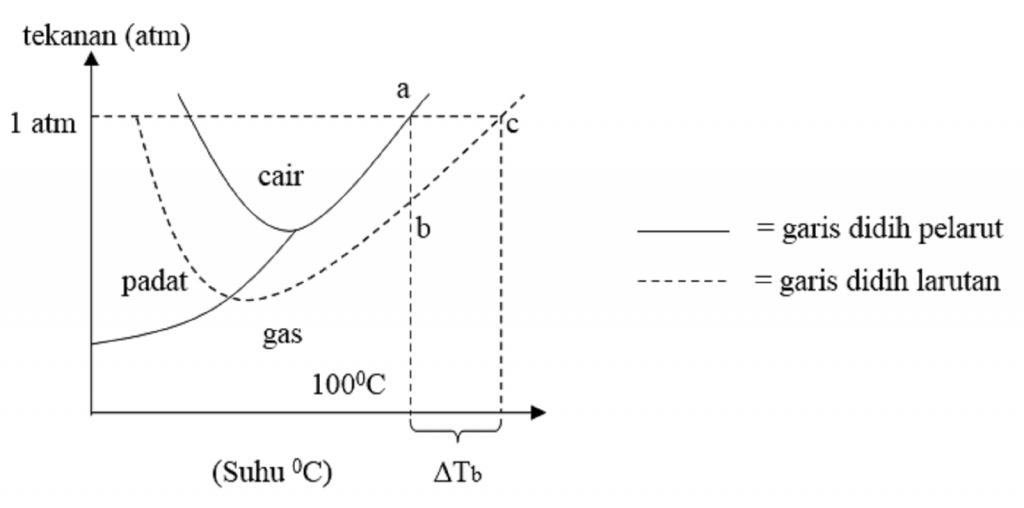
Kenaikan Titik Didih dan Penurunan Titik Beku Untuk memahami konsep kenaikan titik didih larutan kita akan contoh dalam kehidupan sehari-hari yakni apabila ke dalam air dilarutkan suatu zat tertentu, seperti yang kita ketahui akan terjadi penurunan tekanan uap larutan, sehingga pada suhu $\mbox{100}^{\circ}\mbox{C}$ larutan air belum mendidih.

Kenaikan titik didih larutan yang terbentuk dari 18,2 g D...
ΔTb : Tb Larutan-Tb Pelarut. Dengan keterangan : Tb larutan = titik didih larutan. Tb pelarut murni = titik didih pelarut (misal air : 100° C) ∆Tb = kenaikan titik didih. Sebuah larutan mempunyai titik didih yang lebih tinggi dibandingkan dengan titik didih pelarut murninya. Hal itu disebabkan karena larutan harus mencapai suhu di mana.

Rumus titik beku larutan
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Larutan yang memiliki titik beku paling rendah adalah.
Latihan Soal Kenaikan Titik Didih & Penurunan Titik Beku (Sukar) Pertanyaan ke 1 dari 5. Sebanyak 2,85 gram AX2(Mr = 95) dilarutkan ke dalam air sehingga diperoleh 200 mL larutan. Ternyata titik didih larutan tersebut 100, 1404 ∘ C. Ke dalam larutan tersebut ditambahkan 0,95 gram AX2 dan kemudian larutan diencerkan lima kali.

Unduh Contoh soal titik didih dan titik beku larutan (sifat koligatif larutan) Tonton daring
Halo Haruto, kakak bantu jawab pertanyaanmu yaa Titik didih dan titik beku larutan benzena berturut-turut adalah 90,73°C dan -15,07°C. Yuk simak penjelasan berikut, agar kamu lebih paham yaa 😉 Titik beku adalah suhu di mana pelarut cair dan pelarut padat berada pada kesetimbangan, sehingga tekanan uap keduanya sama.

Penurunan Titik Beku Larutan Dan Contoh Soal Faktasantuy Com My XXX Hot Girl
Perlu diketahui, titik didih normal adalah titik didih pada tekanan normal, yaitu tekanan udara luar sebesar 1 atmosfer (atm) atau 76 cmHg. Baca juga: Cara Mencari Jumlah Kalor yang Dibutuhkan untuk Menaikkan Suhu. Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Halo friend. Jadi di video kali ini kita akan membahas mengenai sifat koligatif larutan tepatnya mengenai titik didih dan titik beku di soal diketahui persen massa glikol yaitu 20% Mr glikol, yaitu 02 KB air 0,52 derajat Celcius per molal KF air 1,86 derajat Celcius per molal yang ditanyakan adalah berapa titik didih dari larutan glikol dan titik beku dari larutan glikol diketahui juga titik.

Membaca grafik titik didih dan titik beku larutan, pelarutsifat koligatif YouTube
Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan. Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram. Mr = 60.
Hitunglah tekanan uap, titik didih dan titikbeku l...
Puerto de Mogán. Puerto de Mogán is a picturesque fishing village and popular marina in the municipality of Mogán, set at the mouth of a steep-sided valley on the south-west coast of the island of Gran Canaria. Photo: Wikimedia, CC BY 2.0. Ukraine is facing shortages in its brave fight to survive.
Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Hubungan antara titik beku larutan dan kemolalan ini dapat dituliskan pada rumus berikut ini.. Hitunglah titik beku larutan etilen glikol 25,0% (berdasarkan massa) dalam air! ((K f = 5,38 °C/m Ar C = 12, O = 16,. Pahami Proses Kenaikan Titik Didih, Rumus, dan Penerapannya Juni 13, 2023. Materi Kimia Gaya Antar Molekul, Jenis dan.

Penurunan Titik Beku Larutan Definisi Dan Penyebabnya Reverasite
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K b). Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb. Dengan.