
Detail Tabel Elektron Valensi Koleksi Nomer 10
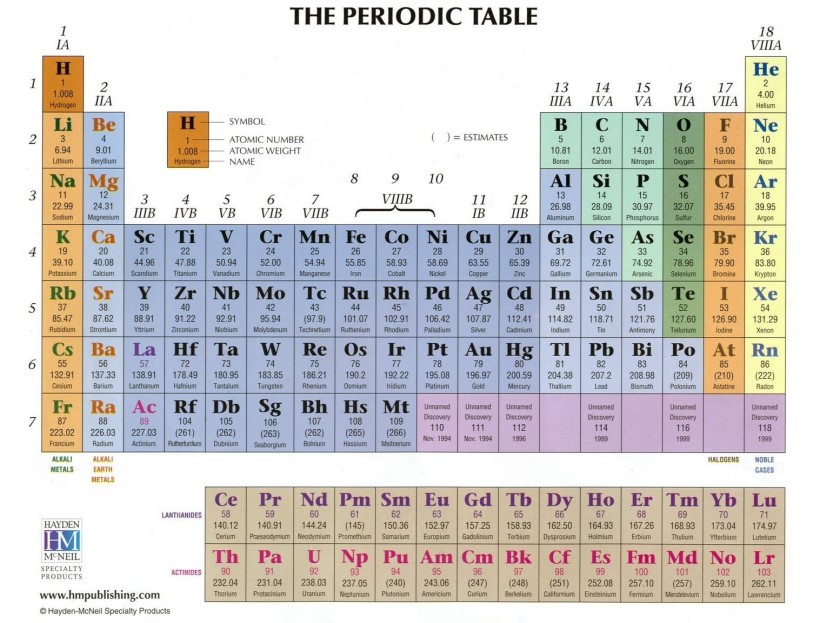
There are two ways to find the number of valence electrons in Iodine (I). The first is to use the Periodic Table to figure out how many electrons Iodine has.
journal of dhamar [SISTEM PERIODIK] Hubungan Sistem Periodik dengan Elektron Valensi Unsurunsur
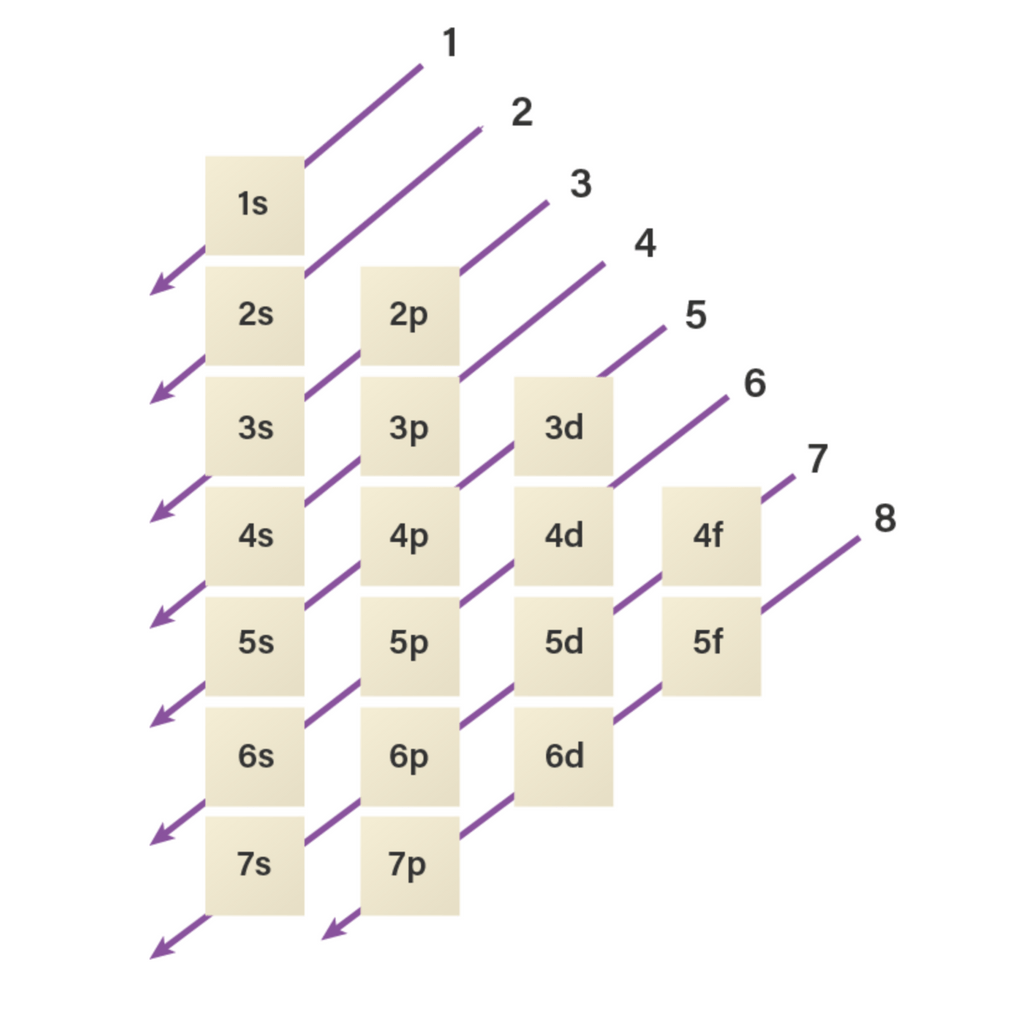
Tabel konfigurasi elektron. Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah hund, larangan pauli, serta hukum mekanika kuantum.

Iodine Electron Dot Diagram
Elektron Valensi. Elektron valensi adalah elektron dalam atom yang berperan dalam pembentukan ikatan kimia. Pada unsur-unsur golongan utama (IA, IIA, IIIA, hingga VIIIA), elektron valensi adalah elektron yang berada pada kulit elektron terluar. Oleh karena itu, kulit elektron terluar sering disebut sebagai kulit valensi.

Iodine Art Print by Carlos Clarivan Electron configuration, Atomic structure, Atom
In chemistry and physics, valence electrons are electrons in the outermost shell of an atom, and that can participate in the formation of a chemical bond if the outermost shell is not closed. In a single covalent bond, a shared pair forms with both atoms in the bond each contributing one valence electron. The presence of valence electrons can.
Elektron valensi 21Sc adalah
Tabel Valensi Kimia Unsur. Anda mungkin berasumsi bahwa valensi unsur—jumlah elektron yang dengannya atom akan terikat atau terbentuk—adalah valensi yang dapat diturunkan dengan melihat golongan (kolom) tabel periodik. Meskipun ini adalah valensi yang paling umum, perilaku elektron sebenarnya kurang sederhana. Berikut adalah tabel valensi.

Apa Itu Elektron Valensi Kompas Sekolah
Elektron valens bagi atom suatu unsur boleh ditunjukkan dengan menggunakan struktuk titik (struktur Lewis). Sifat-sifat kimia sesuatu unsur bergantung kepada bilangan elektron valens kerana hanya elektron valens mengambil bahagian dalam pembentukan dan pemecahan ikatan kimia dalam tindak balas. Ini bermakna unsur-unsur yang mempunyai bilangan.

Tabel Elektron Valensi
Contoh: Unsur natrium dan kalium memiliki sifat yang sama karena masing-masing memiliki elektron valensi = 1. Suatu atom netral dapat melepaskan 1 atau lebih elektronnya dan membentuk ion yang bermuatan positif, atau menangkap elektron dan membentuk muatan negatif. Contoh: 2311 Na mempunyai 11 proton, 11 elektron, dan 12 netron.

Konfigurasi Elektron dan Elektron Valensi
1.3: Valence electrons and open valences. A valence electron is an electron that is associated with an atom, and that can participate in the formation of a chemical bond; in a single covalent bond, both atoms in the bond contribute one valence electron in order to form a shared pair. The presence of valence electrons can determine the element's.

KONFIGURASI ELEKTRON TEORI ATOM BOHR YouTube
valence electron, any of the fundamental negatively charged particles in the outermost region of atoms that enters into the formation of chemical bonds.Whatever the type of chemical bond (ionic, covalent, metallic) between atoms, changes in the atomic structure are restricted to the outermost, or valence, electrons.They are more weakly attracted to the positive atomic nucleus than are the.
Facts About Iodine Live Science
Mengetahui cara mencari jumlah elektron valensi dalam atom tertentu adalah keterampilan penting untuk ahli kimia karena informasi ini menentukan jenis ikatan kimia yang dapat dibentuknya. Untungnya, yang Anda butuhkan untuk mencari elektron valensi hanyalah tabel periodik unsur biasa. Bagian 1.

Konfigurasi Elektron Dan Elektron Valensi Special
Elektron valensi belerang = 6 PEI (X) = 4. Sehingga diperoleh notasi molekul SF 4 adalah AX 4 E dengan bentuk molekul bidang empat. 4. IF 5, dengan atom pusat iodin (EV : 7) Elektron valensi iodin = 7 PEI (X) = 5. Sehingga diperoleh notasi molekul IF 5 adalah AX 5 E dengan bentuk molekul piramida sisi empat. Sumber: Purba, M, Saidah, A. 2014.

KONFIGURASI ELEKTRON MENURUT TEORI ATOM BOHR & ELEKTRON VALENSI (KIMIA SMA KELAS 10) YouTube
Elektron Valensi: Pengertian, Konfirgurasi, Cara Menentukan, Contoh Soal dan Pembahasannya. Elektron Valensi a dalah sebuah elektron di tingkat energi terluar atom yang bisa berpartisipasi dalam interaksi dengan atom lain. Maka karena elektron valensi sangat penting, atom bisa diwakili oleh diagram titik elektron yang menunjukkan hanya terdapat.

Symbol and electron diagram for iodine Royalty Free Vector
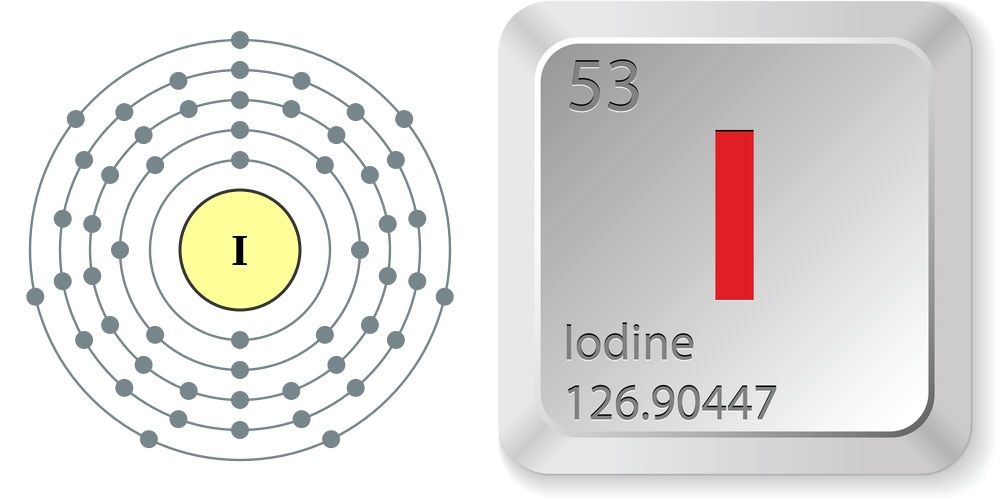
Iodine electron configuration. The 4d orbital is now full. So, the remaining five electrons enter the 5p orbital. Therefore, the iodine complete electron configuration will be 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5. Note: The unabbreviated electron configuration of iodine is [Kr] 4d 10 5s 2 5p 5.

Dari diagram orbital elektron valensi berikut, tuliskan k...
Atom iodin memiliki nomor atom 53. konfigurasi elektron yg benar untuk ion iodin adalah - 7359216. Nursitilaili Nursitilaili 15.09.2016. suatu unsur dikatakan stabil apabila memeiliki elektron valensi yang oktet dan duplet. unsur unsur dibawah ini yg paling stabil adalah a. 8P b. 9Q c..
Konfigurasi Elektron Dan Elektron Valensi Blog Ilmu Pengetahuan
Anda harus masuk untuk berkomentar. Berikut kami sajikan 77 daftar elektron valensi unsur kimia golongan A dan golongan B No. Unsur Konfigurasi Elektron Golongan Elektron Valensi 1. 1H 1s1 IA 1 2. 3Li [He] 2s1 IA 1 3. 11Na [Ne] 3s1 IA 1 4. 19K [Ar] 4s1 IA 1 5. 37Rb [Kr] 5s1 IA 1 6. 55Cs [Xe] 6s1 IA 1.

Tabel Elektron Valensi
Valence Electrons. The electrons in the outermost shell are the valence electrons the electrons on an atom that can be gained or lost in a chemical reaction. Since filled d or f subshells are seldom disturbed in a chemical reaction, we can define valence electrons as follows: The electrons on an atom that are not present in the previous rare gas, ignoring filled d or f subshells.