
Persamaan reaksi kimia yang merupakan reaksi pada uji kua...
Persamaan reaksi kimia adalah suatu pernyataan yang menggambarkan reaksi kimia menggunakan rumus kimia dan lambang-lambang lain.. Kelebihan dan Kekurangan Topologi Ring dalam Jaringan Komputer yang Perlu Diketahui. Dibaca 41 kali. 3. Xavi Sebut Madrid Diuntungkan Wasit, Ancelotti: Tidak Profesional! Dibaca 29 kali. 4.

Persamaan Laju Reaksi Penjelasan, Rumus, Contoh Soal dan Jawaban
Persamaan reaksi dapat dibuat seimbang dengan cara memberikan suatu bilangan yang dinamakan koefisien reaksi. Koefisien reaksi diletakkan di depan rumus kimia senyawa, molekul, atau unsur. Di dalam persamaan reaksi di atas, oksigen kekurangan 1 atom pada produk sehingga kita dapat meletakkan angka 2 sebagai koefisien di depan MgO.

Diketahui persamaan reaksi berikut. Perubahan ent...
Persamaan reaksi : 2 HI(g). Diketahui persamaan reaksi A + 3B → 2C + 2D Molaritas B mula-mula 0,9986 M dan dalam waktu 13,2 menit molaritas B berubah menjadi 0,9746 M. Berapa kecepatan reaksi rata-rata selama waktu tersebut dalam M per detik. a. 1,01 x 10-5. b. 1,01 x 10-4 .

Diketahui reaksi pembakaran etanol berikut. C2H5OH(l)+3O2...
Hi friend pada soal ini diketahui persamaan reaksi belum setara a fe2 + + b mno4 minus + C H plus menjadi dv3 di + MN 12 + H2O setelah reaksi disetarakan perbandingan yang benar adalah yang mana kita akan setarakan reaksinya menggunakan setengah reaksi 12 menjadi fe13 kita setarakan muatannya dikirim muatannya + 26 + 3, sehingga kita tambahkan.

Cara menentukan persamaan laju reaksi jika diketahui data percobaan tidak ada yang sama YouTube
7 Contoh soal hukum Hess dan pembahasannya. Cara menjawab soal ini sebagai berikut. Besarnya ΔH untuk reaksi 2 Al (s) + Fe 2 O 3 (s) → Al 2 O 3 (s) + 2 Fe (s) adalah.. Cara menjawab soal ini sebagai berikut. Besarnya ΔH pada reaksi NH 3 (g) + HCl (g) → NH 4 Cl (s) adalah.. Cara menjawab soal ini sebagai berikut.

Persamaan Reaksi Dan Hukum Dasar Kimia
Menentukan perubahan bilangan oksidasi dan menyamakan perubahan bilangan oksidasinya. 2. Memberikan koefisien reaksi pada reaksi oksidasi dan reduksinya sesuai angka pengalinya. 3. Menyamakan jumlah muatan pada kedua ruas persamaan reaksi. 4. Menyamakan jumlah dengan menambahkan . Maka koefisiennya: Jadi, jawaban yang benar adalah D.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI JIKA DATA YANG DIKETAHUI WAKTU YouTube
Orde reaksi pada reaksi secara keseluruhan disebut seaagai orde reaksi total. Besarnya orde reaksi total adalah jumlah semua orde reaksi pereaksi. Sehingga, orde reaksi total (orde reaksi) pada reaksi tersebut di atas adalah m + n. Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban.

10 Contoh Soal Persamaan Reaksi Kelas 10 Materi Kimia
Masuk. Kimia. Kimia Fisik dan Analisis Kelas 12 SMA. Reaksi Redoks dan Sel Elektrokimia. Penyetaraan Persamaan Reaksi Redoks. Diketahui reaksi : aZn+bNO3^(-) -> cZn^(2+)+NH4^+ (suasana asam) Jika reaksi diatas disetarakan makan koefisien a, b, dan c berturut-turut adalah. Penyetaraan Persamaan Reaksi Redoks. Reaksi Redoks dan Sel Elektrokimia.

Perhatikan beberapa persamaan reaksi kimia dalam kehidupa...
Contoh Soal Persamaan Reaksi Kimia & Jawabannya. Tuliskan persamaan suatu reaksi antara larutan perak nitrat dengan larutan kalsium klorida menghasilkan endapan perak klorida dan larutan kalsium nitrat. Reaktan: perak nitrat : AgNO3(aq), kalsium klorida: CaCl2(aq) Produk: perak klorida: AgCl(s), kalsium nitrat : Ca(NO3)2(aq) AgNO3(aq) + CaCl2.

Diketahui suatu reaksi 2 H_(2)(g)+O_(2)(g) > 2 H_(2) O...
Diketahui persamaan reaksi: C(s) + O2(g) → CO2(g) ΔH = -394 kJ 2Ca(s) + O2(g) → 2CaO(s) ΔH = -1275 kJ CaO(s) + CO2(g) → CaCO3(s) ΔH = -181 kJ Besarnya ΔH rea.
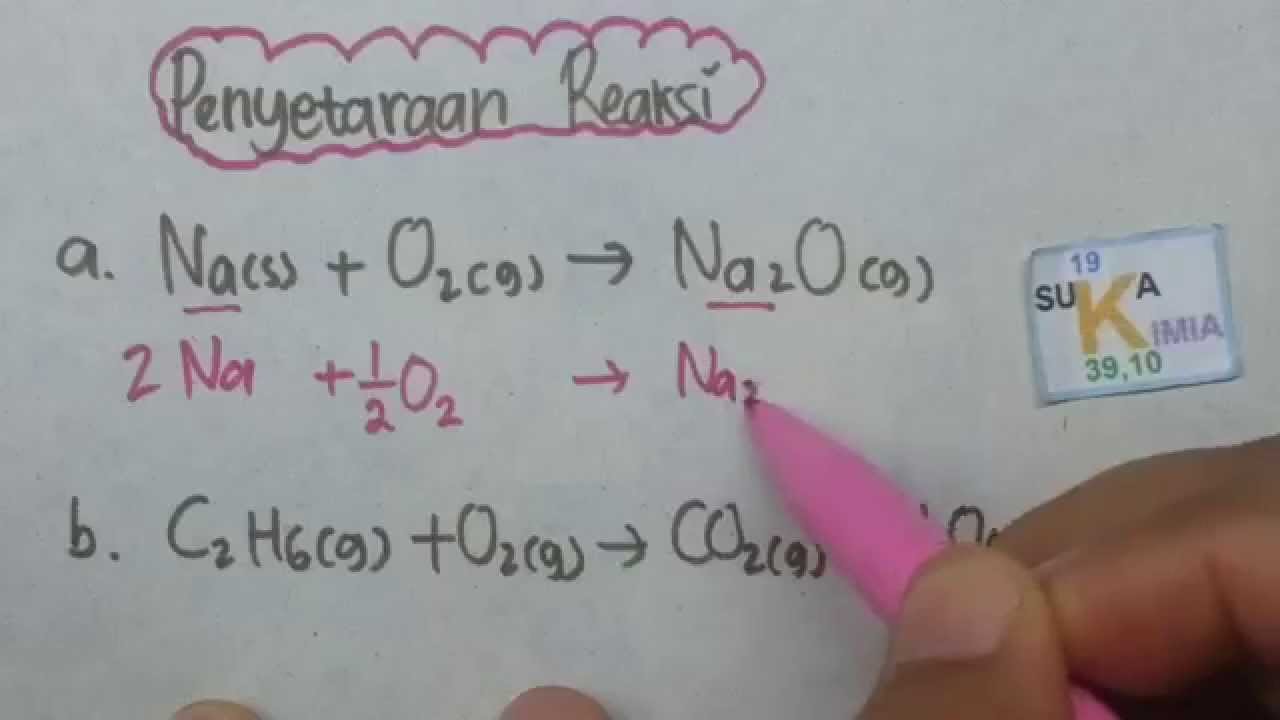
Contoh Soal Persamaan Reaksi Kimia Dan Jawabannya Contoh Soal Terbaru
Reaksi 1 merupakan pembakaran 1 mol gas CO dan reaksi 2 merupakan pembakaran 2 mol gas CO dengan ⧋ H reaksi yang meripakan kelipatan koefisiennya. Fase zat yang berbeda akan menghasilkan ⧋ H yang berbeda pula. Jenis-jenis Perubahan Entalpi Standar. Ada beberapa jenis perubahan entalpi standar, yaitu:

persamaan laju reaksi, UN kimia 2016 pembahasan 024 YouTube
Jawaban: Reaksi: Kita misalkan c= 1. Jumlah Al kanan= 2, maka Al di kiri harus 2, sehingga a= 2. Jumlah O di kanan= 3, maka O di kanan =3/2, sehingga b= 3/2. (keseluruhan reaksi kita kalikan 2) Maka, jawaban yang tepat adalah A. Baca Juga: Larutan Senyawa Ionik dan Kovalen - Materi Kimia Kelas 10. Yeay, akhirnya selesai juga materi tentang.

Diketahui persamaan reaksi berikut. CH4(g) > C(s) + 2H2(...
40. Diketahui beberapa persamaan reaksi berikut: 2 NiS + 3O 2 → 2NiO + 2 SO 2; Cl 2 + 2e → 2Cl; AgNO 3 + NaCl → AgCl + NaNO 3; KIO 3 → KIO 4; Reaksi oksidasi terdapat pada nomor…. a. 1 dan 2 . b. 1 dan 4 . c. 2 dan 3. d. 2 dan 4. e. 3 dan 4. Penyelesaian : Jawaban : B. Reaksi reduksi: Reaksi yang melepas oksigen; Yang mengikat elektron
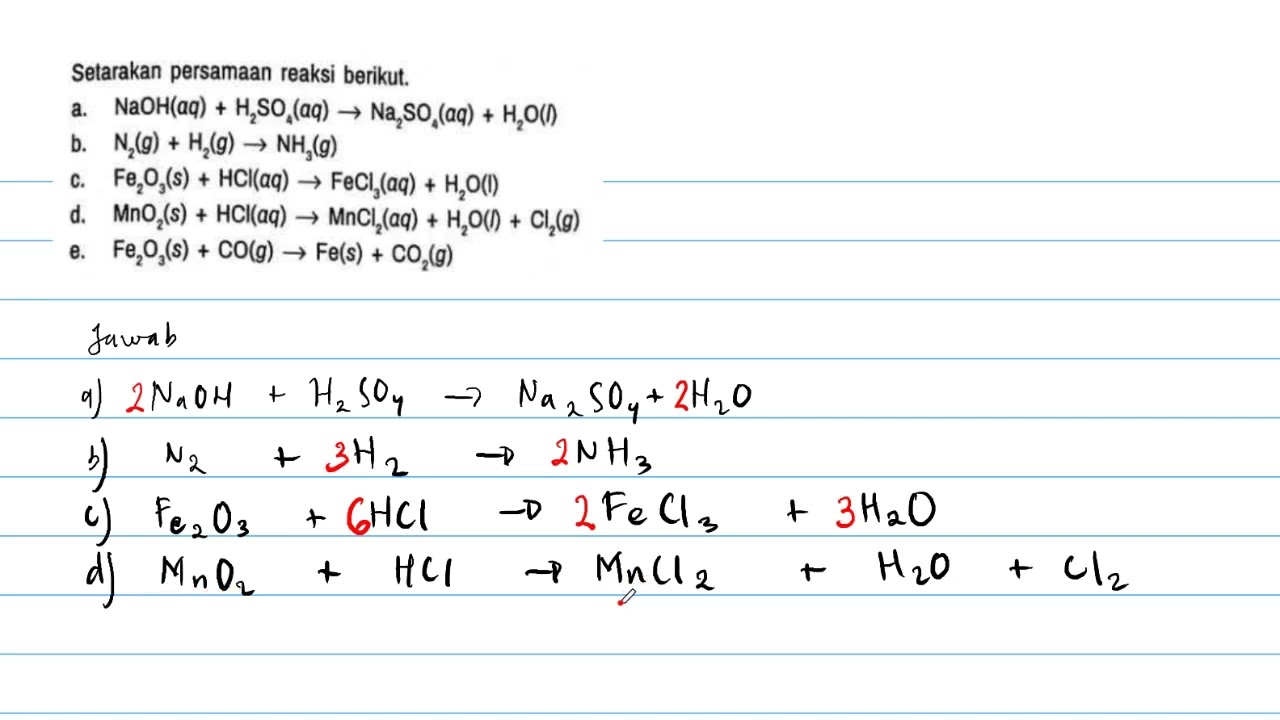
Setarakan persamaan reaksi berikut YouTube
Persamaan reaksi setara: Al 2 O 3 (s) + 6HCl(aq) → 2AlCl 3 (aq) + 3H 2 O(l) Persamaan reaksi dikatakan setara, bila jumlah atom-atom zat-zat pereaksi (pada ruas kiri) sama dengan zat-zat hasil reaksi (pada ruas kanan). Apabila jumlah atom sebelum dan sesudah reaksi belum sama, maka perlu disetarakan dengan cara membubuhkan koefisien reaksi.
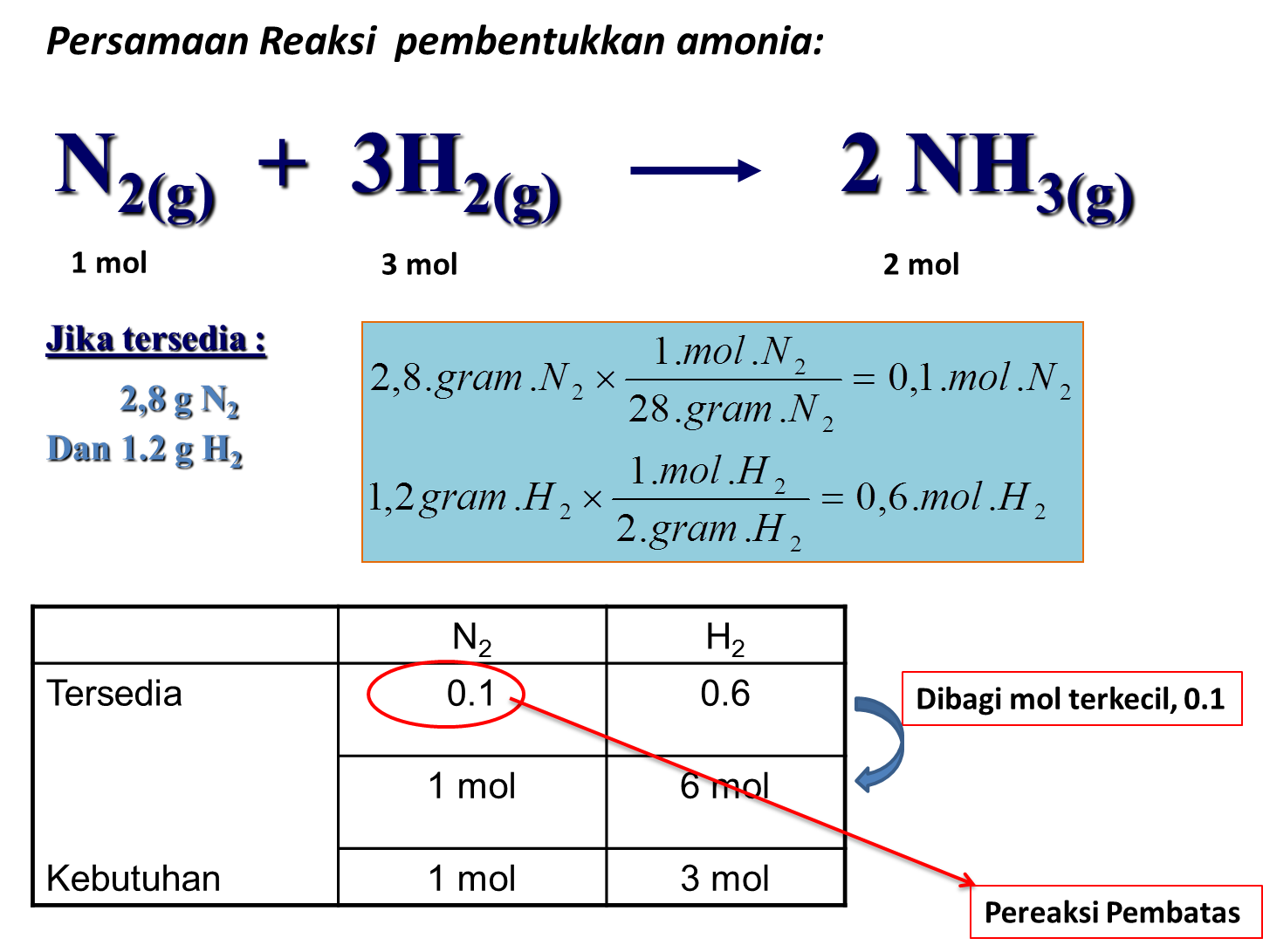
Rumus Kimia Persamaan Reaksi Dan Stoikiometri My XXX Hot Girl
Orde-orde Reaksi. 1. Orde reaksi 0. Laju reaksi tidak bergantung pada konsentrasi. Persamaan reaksi yang berorde 0 yaitu v = k [A]0. 2. Orde reaksi 1. Laju reaksi berbanding lurus dengan konsentrasi pereaksi. Jika konsentrasi dinaikkan dua kali, maka laju reaksinya pun akan dua kali lebih cepat dari semula, dst.

Diketahui persamaan reaksi berikut. Na2B4O7(s)+xH2O(l)+2H...
Mungkin kamu bertanya-tanya, apa sih orde itu? Orde adalah pangkat dari tiap pereaksi. Dari reaksi AB + C 2 → ABC 2 diketahui: Orde reaksi AB = 2; Orde reaksi C 2 = 1; Jadi, orde reaksi totalnya adalah 2 + 1 = 3. Contoh Soal 9. Suatu reaksi berlangsung seperti persamaan berikut. P + 2Q → R. Perhatikan data hasil percobaan berikut.