Pengertian Molekul, Rumus, Model, Tipe, Teori, Rumus, Contoh
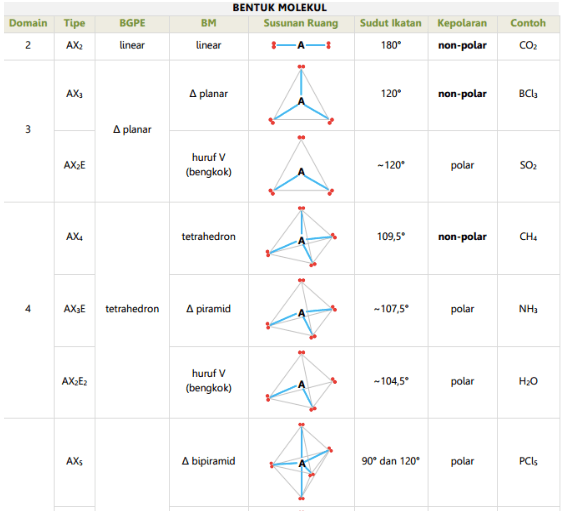
Bentuk molekul dari senyawa berdomain 2 ini adalah LINEAR. Contoh-contoh selanjutnya akan disajikan sebagai tabel. Berikut tabelnya: 11 Nama Jumlah Struktur Lewis Bentuk Molekul Bentuk Domain Molekul 2 Linear BeH2 Segitiga 3 Datar BF3 4 Tetrahedral CH4 Segitiga 5 Bipiramidal PCl5 (penampakan samping) 12 Nama Jumlah Struktur Lewis Bentuk Molekul.

Catatan Melix Geometri Molekul
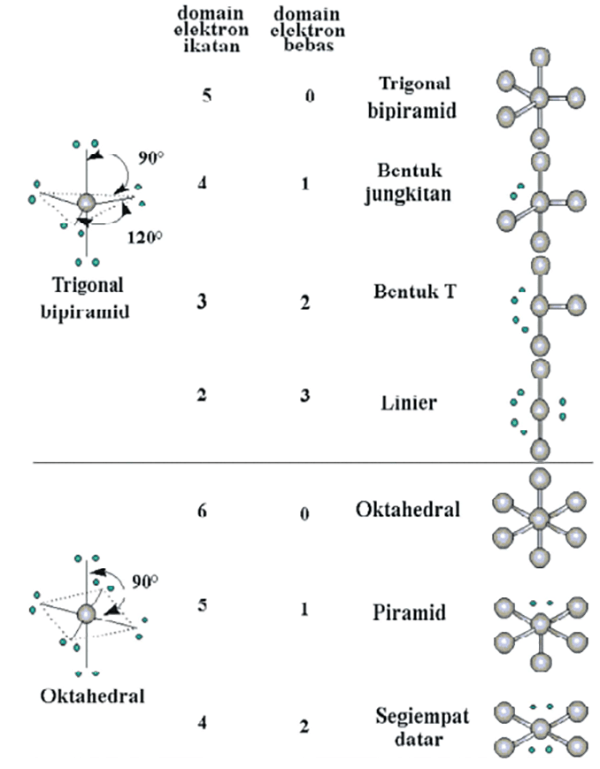
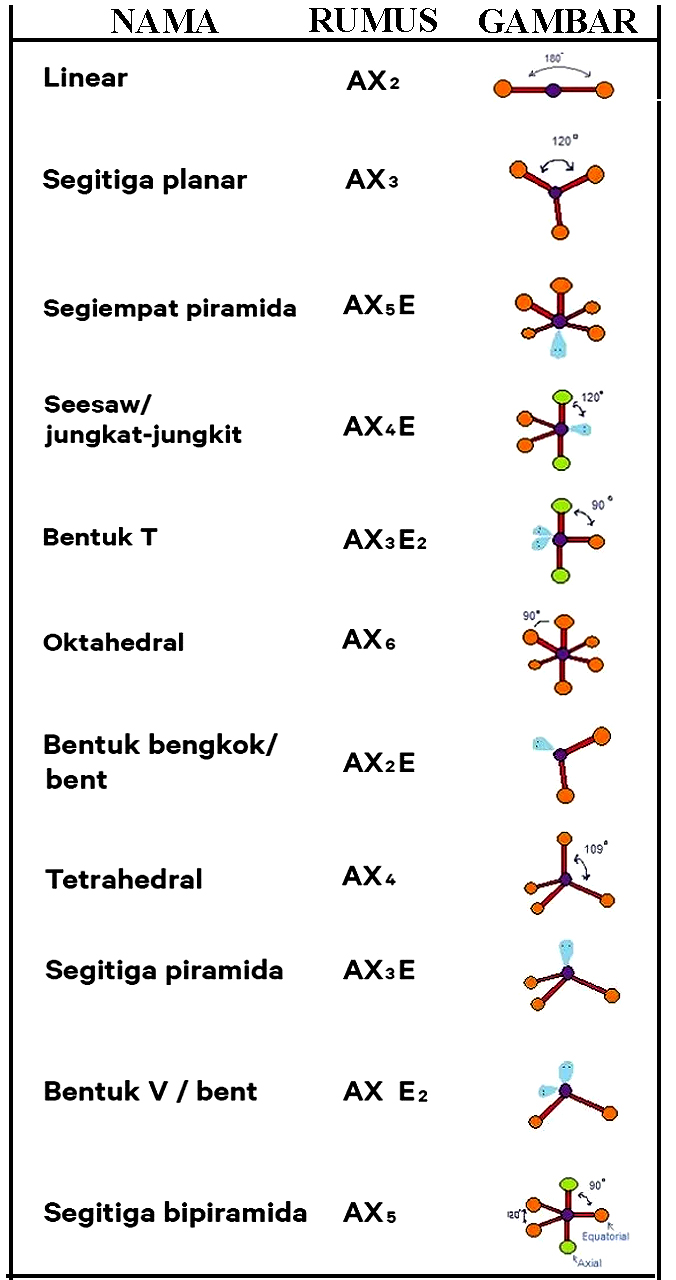
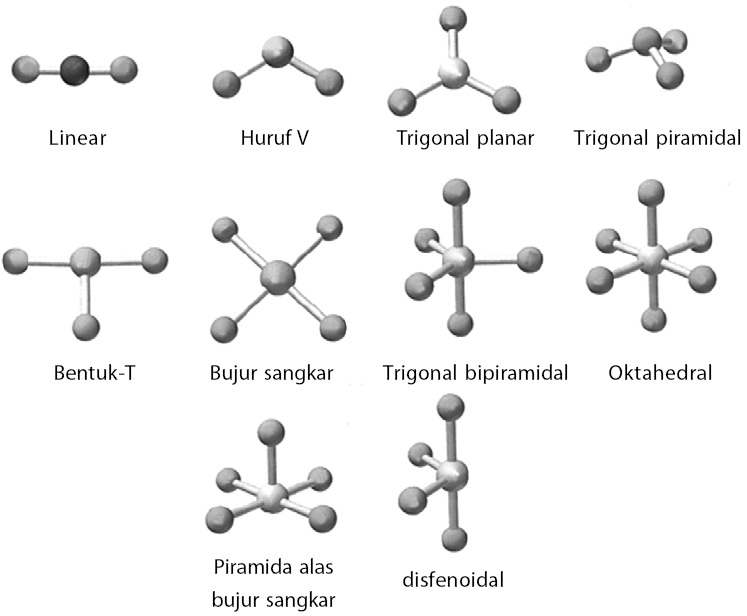
n: jumlah PEI dalam molekul. E: pasangan elektron bebas (PEB) m: jumlah PEB dalam molekul. Ada 11 bentuk molekul berdasarkan teori domain elektron, yaitu linear, segitiga planar, segiempat piramida, seesaw atau jungkat-jungkit, bentuk T, oktahedral, bentuk bengkok, tetrahedral, segitiga piramida, bentuk V, dan segitiga bipiramida.

Bentuk Molekul Tipe dan Teori VSEPR, Domain Elektron dan Hibridasi Quipper Blog
KOMPAS.com - Notasi VSEPR merupakan metode untuk menentukan bentuk molekul sesuai dengan teori VSEPR (Valence Shell Electron Repulsion).. Notasi VSEPR membantu menentukan molekul menjadi lima molekul dasar yaitu linear, trigonal, planar, tetrahedral, trigonal bipiramidal, dan oktahedral.. Rumus notasi VSEPR. Notasi VSEPR menentukan bentuk molekul melalui rumus umum yang memperhitungkan.
Cara Menentukan Bentuk Geometri Molekul
Teori Bentuk Molekul. 1. Teori VSEPR. Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron "mandiri") saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain.

Tabel Bentuk Molekul Berdasarkan Pei Dan Peb Berbagi Bentuk Penting
Bentuk Linear: Atom-atom penyusun molekul sejajar membentuk garis lurus. Contoh: CO2. Bentuk Planar Trigonal: Atom-atom penyusun molekul berada dalam satu bidang dan membentuk sudut 120 derajat. Contoh: BF3. Bentuk Tetrahedral: Empat atom penyusun molekul disusun membentuk sudut 109,5 derajat dalam bentuk tiga dimensi seperti piramida. Contoh: CH4.

MacamMacam Bentuk Molekul
Beberapa bentuk umum molekul sederhana meliputi: Linear: Dalam model linear, atom dihubungkan dalam garis lurus. Sudut ikatan ditetapkan pada 180 °. Misalnya, karbon dioksida dan nitrat oksida memiliki bentuk molekul linear. Trigonal planar: Molekul dengan bentuk planar trigonal agak segitiga dan dalam satu bidang. Akibatnya, sudut ikatan.
PPT BENTUK MOLEKUL PowerPoint Presentation, free download ID4027517
Dalam bentuk ini, dua atom terikat secara linear, dan terdapat dua pasangan elektron non-ikatan di sekitar atom pusat, sehingga membentuk sudut ikatan yang lebih kecil daripada bentuk linear. Contoh umum dari molekul dengan bentuk bent adalah air (H2O). Atom pusat pada H2O adalah oksigen (O) dengan dua atom hidrogen (H) terikat pada oksigen.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
Mengutip World of Molecules, berikut adalah jenis-jenis molekul: 1. Molekul diatomik. Sebuah atom diatomik terdiri dari hanya dua atom, dari unsur kimia yang sama atau berbeda. Contoh molekul diatomik adalah O2 dan CO. 2. Molekul diatomik heteronuklear. Sebuah molekul diatomik heteronuklear terdiri dari dua atom dari unsur yang sama digabungkan.

Bentuk Molekul berdasarkan Teori Domain Elektron dan Teori Hibridisasi Kimia Kelas 10
Baca juga: 3 Partikel Penyusun Materi: Atom, Molekul, dan Ion. Bentuk linear. Suatu molekul dikatakan linear jika atom-atom yang menyusun molekul tersebut berada dalam suatu garis lurus. Contohnya, BeCl2, dan CO2. Sudut yang dibentuk oleh ikatan antara dua atom melalui atom pusat sebesar 180°. Trigonal planar. Suatu bentuk molekul dikatakan.
Pengertian Gaya Antar Molekul, Struktur, Sifatsifat, Bentuk, Contoh Soal, Teori Domain Elektron
Contoh molekul yang memiliki bentuk linear adalah senyawa BeCl 2. Bentuk linear tersebut terjadi salah satunya karena atom pusat tidak memiliki pasangan elektron bebas, dan hanya memiliki dua ikatan. Baca juga: Sistem Periodik Unsur. b. Bentuk Molekul Segitiga Datar.
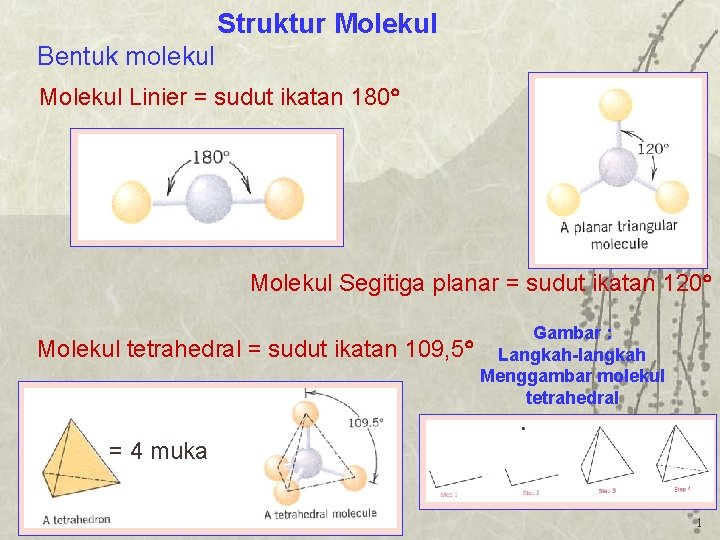
Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Adapun bentuk linear adalah suatu molekul dari beberapa atom yang tersusun dan berada dalam satu garis lurus. Sudut yang dibentuk pada posisi tersebut, berada dalam ikatan dua atom yang melalui atom pusat sebesar 180 derajat.. Contoh dari molekul bentuk ini adalah molekul NH3. Baca juga: Fungsi Erlenmeyer sebagai Alat Laboratorium Lengkap.
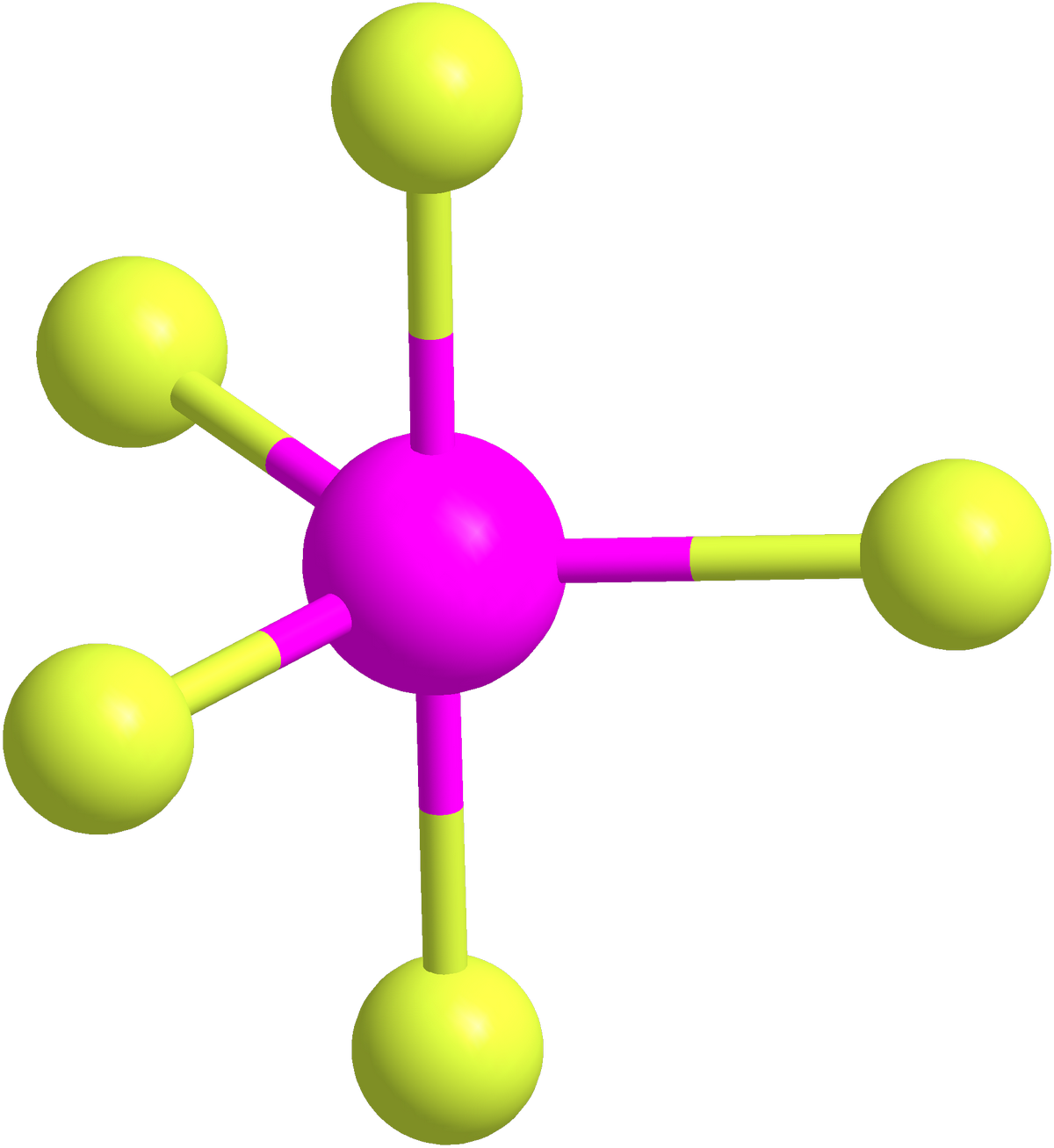
Bentuk Molekul PF5 MateriKimia
Terdapat sekitar tujuh bentuk molekul yang sederhana, yaitu bentuk linear, trigonal planar, trigonal piramidal, segiempat datar, tetrahedral, tirogonal bipiramidal, dan oktahedral. Soalkimia.com Kali ini akan menyediakan contoh soal Cara Menentukan Bentuk Molekul (PEB dan PEI) sebanyak 11 butir yang kami rangkum dari berbagai penerbit buku.
Materi Bentuk Molekul Berdasarkan Teori VSEPR & Domain Elektron kelas 10 SMA/MA + Latihan Soal
Tentang Bentuk Molekul dan Hibridisasi. jumlah domain elektron pada molekul tersebut. berdasarkan teori domain elektron dan juga teori vsf. menurut teori vsf terbentuk suatu molekul itu dipengaruhi oleh gaya. Simak materi video belajar Bentuk Molekul dan Hibridisasi Kimia untuk Kelas 11 secara lengkap yang disertai dengan animasi menarik.
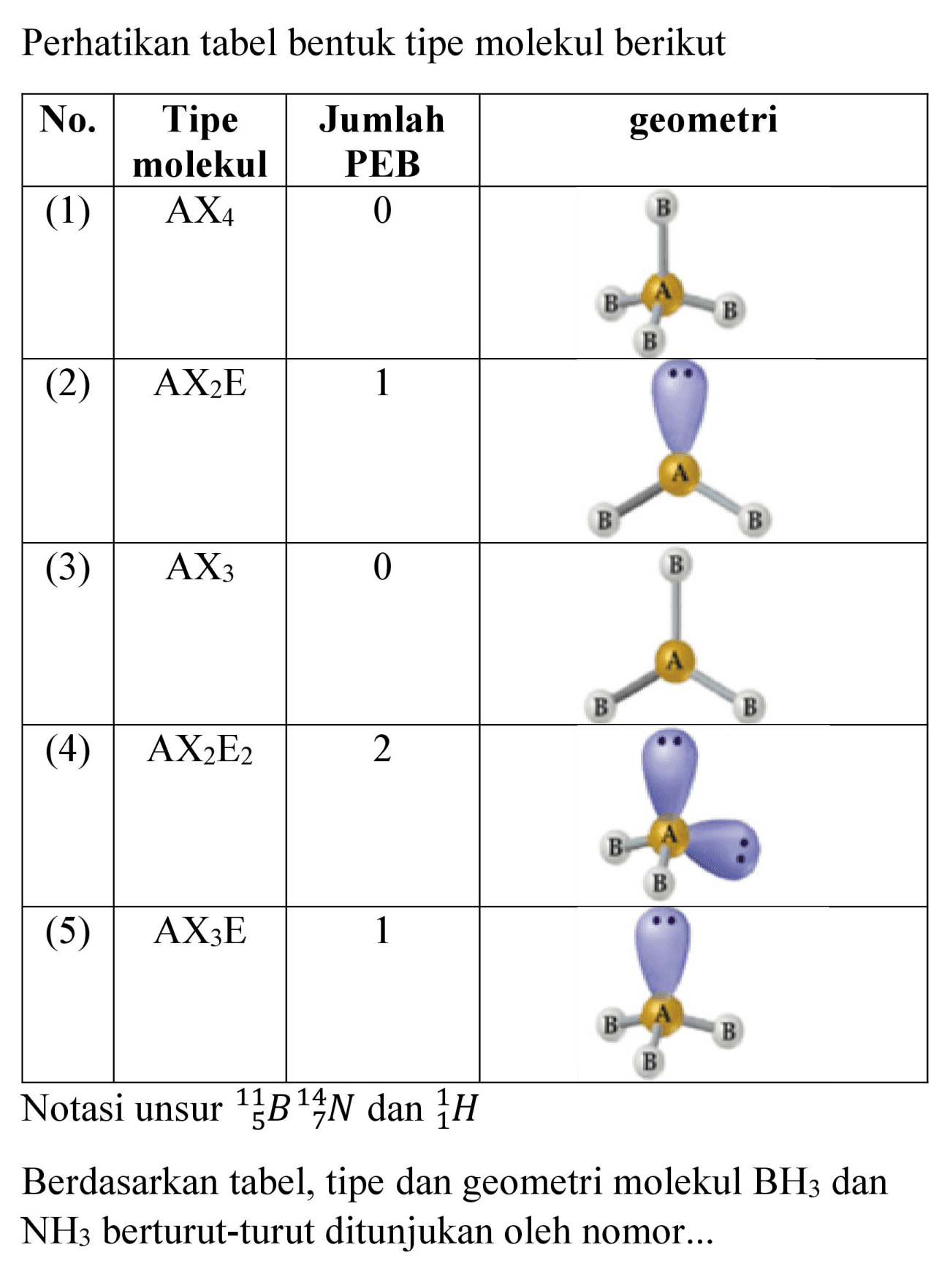
Ramalkan bentuk molekulmolekul di bawah ini dengan mengg...
Contohnya, molekul CO2 yang mengandung ikatan rangkap dua. Menurut teori domain elektron, bentuk molekul CO2 dapat dianggap sebagai dua gugus pasangan elektron ikatan, seperti pada molekul BeCl2 . Oleh karena itu, bentuk molekul CO2 dianggap linear (perhatikan Gambar 2.5a). Contoh molekul lain dengan ikatan rangkap tiga adalah HCN.
Cara Paling Mudah Menentukan Bentuk Molekul Ion Poliatomik Serba Ada
Bentuk molekul erat kaitannya dengan susunan ruang atom-atom dalam molekul. Misalnya molekul diatomik memiliki bentuk molekul linear, molekul triamotik dapat berbentuk linear maupun bengkok, molekul tetraatomik berbentuk planar (datar sebidang) atau piramida. Semakin banyak atom penyusun molekul, semakin kompleks pula bentuk/ geometrinya.

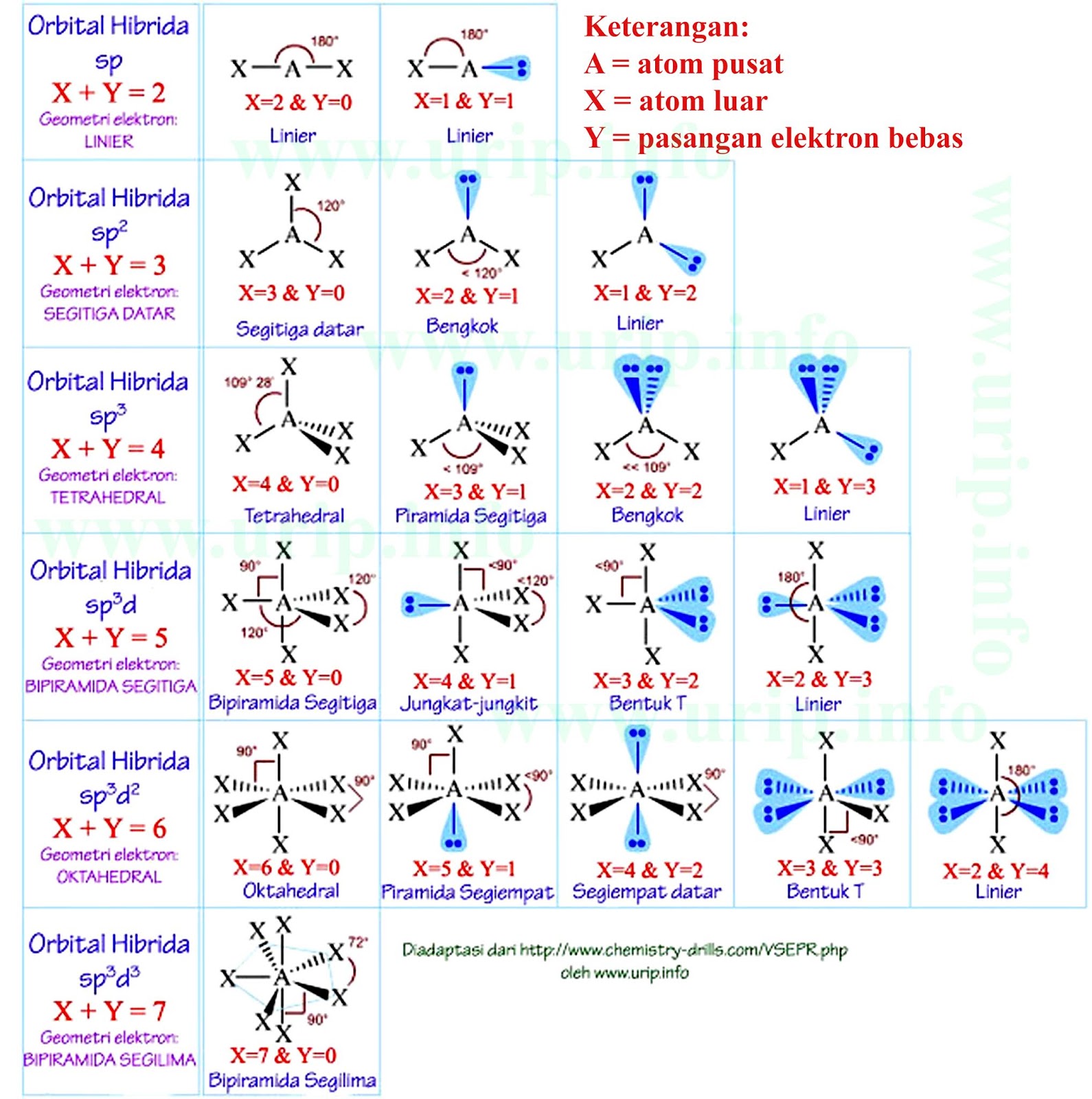
Download Gambar Bentuk Molekul dan Cara Memanfaatkannya Urip dot Info
Ada 11 bentuk molekul berdasarkan teori ini, antara lain: linear (AX2), segitiga planar (AX3), segiempat piramida (AX5E), T-shape (Ax3E2), dll. Teori Hibridisasi Terakhir, ada teori hibridisasi yang menyatakan bahwa suatu ikatan molekul terjadi akibat terbentuknya orbital hibrida pada sub orbital atomnya.