
Mana yang berfungsi sebagai asam, basa, asam konjugasi, d...
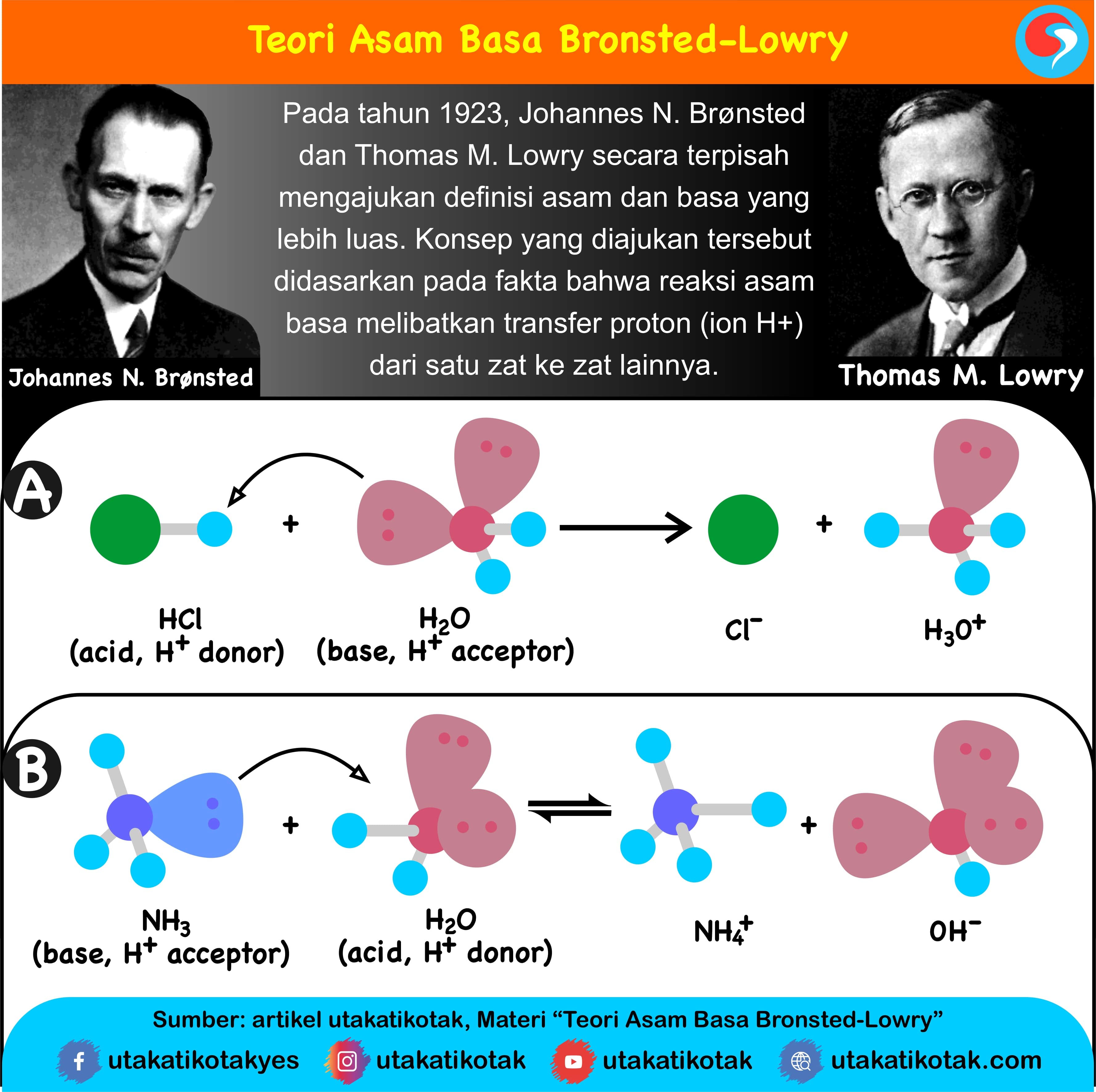
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Basa
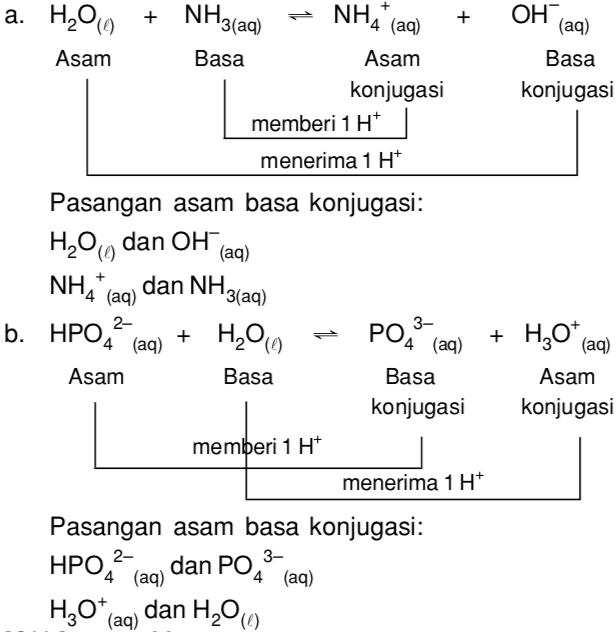
Berdasarkan teori asam basa Bronsted-Lowry, jika dalam suatu reaksi asam dan basa, apabila asam mendonorkan protonnya, maka akan dihasilkan spesies basa konjugasi, sedangkan basa yang menerima proton akan menghasilkan spesies asam konjugasi. Nah, itulah yang dimaksud dengan pasangan asam dan basa konjugasi. Untuk lebih mudahnya, perhatikan 23 pasangan asam dan basa konjugasi berikut: No. Asam

Asam dan Basa Konjugasi
Asam dan Basa Konjugasi - RumusKimia.net berikut akan berbagi penjelasan tentang Asam dan Basa Konjugasi. Untuk pengertian Asam dan Basa Konjugasi.. Contoh Soal Asam dan Basa Konjugasi. Berikut ini contoh pasangan asam-basa konjugasi pada beberapa reaksi. a. HNO 3(aq) + H 2 O (l) ⇄H 3 O + (aq) + NO 3.
Asam Dan Basa Konjugasi Dengan Contoh Soal Rumus Kimia Riset
Sedangkan, jika pH larutan lebih besar dari 7, maka larutan tersebut bersifat basa. Contoh Penerapan Rumus Asam Konjugasi. Untuk memahami lebih jelas tentang rumus asam konjugasi, berikut ini adalah contoh penerapannya: Diberikan asam klorida (HCl) dan basa amonia (NH3). Hitunglah rumus asam konjugasi dari masing-masing zat.

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Reaksi NH4 ke NH3. Asam Basa Konjugat - Konjugasi Asam Basa - Rumus, Konjugat, Contoh Soal dan Jawaban. Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium.Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air.

Pasangan asambasa konjugasi dari reaksi NH3(aq)+H2O(l)
Asam lemah: HA + H 2 O ⇌ H 3 O + + A - (basa kuat) Basa sesaat setelah menerima proton akan berubah menjadi asam konjugasi dari basa tersebut. Contoh tipe reaksi: Basa kuat: B + H + → BH + (asam lemah) Bila ditulis secara lengkap: Basa kuat: B + H 3 O + → BH + (asam lemah) + H 2 O. Basa lemah: B + H + ⇌ BH + (asam kuat) Bila ditulis.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
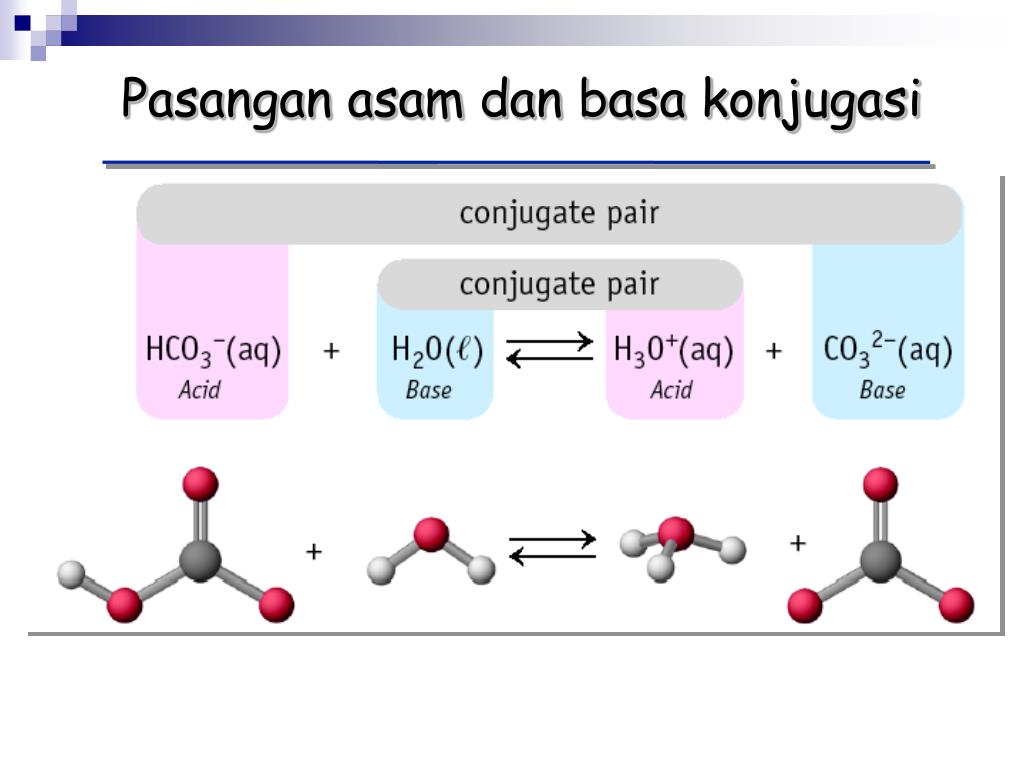
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Teori asam basa Bronsted Lowry menjelaskan rumus kimia dari pasangan asam basa konjugasi dan hanya berbeda satu proton H+ saja. Reaksi di bawah HCl merupakan asam karena telah memberikan proton serta NH3 serta merupakan basa karena menerima proton. Sementara ion Cl- adalah basa konjugasi dari HCl dan NH4+ adalah asam konjugat dari NH3.

Asam basa konjugasi kimia SMA YouTube
2. Konstanta Disosiasi Asam: Pasangan asam basa konjugasi memiliki nilai konstanta disosiasi asam (Ka) yang berbeda. Ka menyatakan sejauh mana asam akan melepaskan protonnya dalam larutan. Semakin besar nilai Ka, semakin kuat asam tersebut. Sebagai contoh, asam asetat (CH3COOH) memiliki basa konjugasi asetat (CH3COO-) dengan Ka yang lebih kecil.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa Brønsted-Lowry . Perhatikan persamaan pelarutan asam nitrat dalam air berikut.

Asam basa konjugasi soal kimia SMA YouTube
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H +) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen.Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Dua ilmuwan ini juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang menerima ion H+, sedangkan basa konjugasi adalah asam yang telah mendonorkan atau melepaskan ion H +. Sebagai contoh, ketika asam asetat (CH 3 COOH) dilarutkan dalam air, maka akan terjadi reaksi berikut ini.

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
Video berisi tentang cara menentukan pasangan asam basa konjugasi dari teori asam basa Bronsted-Lowry. Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semu.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Asam konjugasi menurut teori asam-basa Brønsted-Lowry dibentuk oleh penerimaan proton (H+) oleh basa; dalam kata lain, asam konjugasi adalah basa yang telah memperoleh ion hidrogen. Di sisi lain, basa konjugasi adalah yang tersisa setelah asam telah memberikan proton dalam suatu reaksi kimia. Maka dari itu, basa konjugasi dibentuk oleh pelepasan proton dari suatu asam.

Trik Menentukan Pasangan Asam Basa Konjugasi KIMIA OKE PINTAR
Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry! Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya. Artinya, asam melepaskan proton (H+) untuk mencapai kesetimbangan reaksi dan berubah menjadi basa.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
Bronsted Lowry juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang memperoleh ion hidrogen, sedangkan basa konjugasi adalah yang tersisa setelah asam memberikan proton dalam sebuah reaksi kimia.. Berikut ini contoh asam dan basa yang ada di sekitarmu: Asam. Jeruk yang mengandung C 6 H 8 O 7. Cuka yang mengandung CH 3.