
Cara Simpel Menentukan Biloks Unsur YouTube
Dengan demikian, berdasarkan aturan biloks, maka biloks dari unsur-unsur bebas tersebut adalah 0. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS! 11. 5.0 (1 rating) Iklan. Iklan. Klaim Gold gratis sekarang! Dengan Gold kamu bisa tanya soal ke Forum sepuasnya, lho..
LENGKAP ‼️MENENTUKAN BILOKS UNSUR DALAM SENYAWA YouTube
Bilangan oksidasi unsur bebas adalah 0.. Ingat aturan biloks poin 6, jumlah biloks unsur-unsur yang membentuk senyawa = 0. Jadi, apabila biloks Al dan H dijumlahkan, hasilnya harus 0. Agar biloks Al + biloks H = 0, biloks H haruslah -3. Karena atom H memiliki indeks 3, maka biloks H : indeks H = -3 : 3 = -1..

Aturan Menentukan Bilangan Oksidasi atau Biloks Mudah Diingat Kimia X dan XII YouTube
Sebuah unsur dalam bentuk bebas memiliki biloks = 0. Dalam senyawa atau ion, jumlah bilangan oksidasi sama dengan muatan total senyawa atau ionnya. Fluorin dalam senyawa memiliki biloks = −1; ini meluas ke klorin dan bromin hanya jika tidak terikat pada oksigen, nitrogen, atau halogen yang lebih ringan.

Biloks Unsur Bebas Adalah PDF
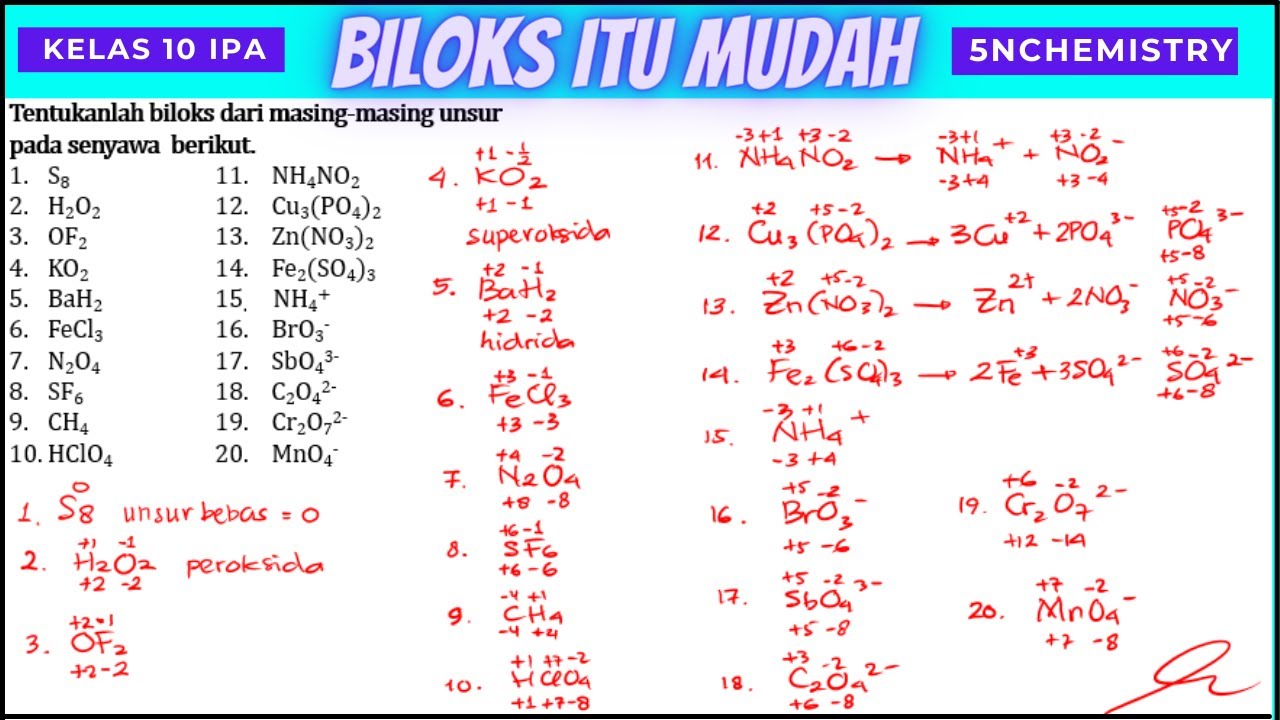
Postingan ini membahas contoh soal bilangan oksidasi atau biloks dan pembahasannya / penyelesaiannya. Bilangan oksidasi adalah nilai muatan atom dalam sebuah senyawa atau ion. Ketentuan dalam menentukan biloks sebagai berikut: Atom unsur bebas seperti O2, N2, Fe dan lainnya mempunyai biloks = 0.Atom logam golongan IA (Li, Na, K, Rb, Cs) mempunyai biloks = +1.Atom

Bilangan Oksidasi (Biloks) Unsur dalam Senyawa atau Ion Materi Kimia
Unsur bebas dengan bentuk atom, sebagai contoh: Cu, K, Ca, C, Nae, Fe, Al, Na;. Sehingga biloks unsur Mg pada senyawa MgSO 2 adalah +2 atau unsur Ca pada senyawa CaCl 2, CaSO 4, dan CaO juga +2. Golongan IIIA seperti B, Al, Ga, In, Tl memiliki bilangan oksidasi +3. Sehingga bilangan oksidasi unsur Al di senyawa Al 2 O 3 adalah +3. 4.

BILANGAN OKSIDASI (BILOKS) YouTube
Bilangan oksidasi unsur bebas (berbentuk atom, atau molekul unsur) adalah 0 (nol). Unsur bebas berbentuk atom.'. Tentukan BILOKS unsur yang digarisbawahi pada senyawa berikut. Fe 2 O 3; H 2 O 2; MnO 4; Jawab: 1) Fe 2 O 3. bilangan oksidasi O = -2 (aturan c) 2 biloks Fe + 3 biloks O = 0

Tentukan biloks masingmasing unsur dalam senyawa atau io...
Unsur bebas adalah unsur-unsur yang tidak stabil dan tidak berikatan kimia dengan unsur lain, baik berupa atom-atom bebas atau molekul homoatomik. Contoh:. biloks Cl = +5. Jadi, bilangan oksidasi unsur Na, Cl, dan O dalam NaClO3 adalah +1, +5, dan -2. Soal 2. Tentukan bilangan oksidasi unsur-unsur penyusun senyawa KMnO4!

Aturan penentuan biloks
H 2 merupakan unsur bebas, jadi biloks H 2 = 0. Sementara itu, biloks H pada senyawa H 2 O bernilai +1. Jadi, unsur H mengalami kenaikan biloks dari 0 ke +1, sehingga mengalami reaksi oksidasi. H2 ——> H2O (reaksi oksidasi) Paham ya dengan penentuan reaksi redoks berdasarkan bilangan oksidasi. Dalam hal ini, kamu memang perlu paham betul.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

PENYETARAAN REDOKS DENGAN CARA BILOKS UNTUK REAKSI ION (Part 1) YouTube
Biloks unsur bebas adalah 0. Jumlah bilangan oksidasi unsur-unsur yang membentuk senyawa = 0. Biloks unsur pada golongan logam IA, IIA, dan IIIA sesuai dengan golongannya. Biloks oksigen ( O ) dalam senyawa proksida = -1. Bilangan oksidasi O dalam senyawa non-peroksida = -2. 1.Penentuan biloks Mn dalam senyawa MnSO 4 biloks MnSO 4 0 biloks Mn.

Menentukan reaksi redoks atau bukan berdasarkan perubahan biloks YouTube
Bilangan oksidasi atom dalam unsur bebas netral sama dengan nol. Contohnya, biloks Fe, Li, Na, O2, dan P4 sama dengan nol. Bilangan oksidasi ion tunggal atau monoatomik sama dengan jumlah muatan ionnya. Misalnya, biloks Cl- adalah -1 dan biloks Au3+ sama dengan +3.

Penyetaraan Reaksi Redoks Metode Biloks Pada Kondisi Basa 1 YouTube
Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1. Gol II: Be, Mg, Ca, dan Ba → biloks = +2

Bilangan Oksidasi Kimia Biloks Tabel Biloks Contoh Soal Dan Jawaban Gambaran
Aturan menentukan biloks. Biloks unsur bebas = 0, unsur bebas adalah materi yang tersusun atas atas satu jenis atom. Contoh: Na, $\mbox{N}_{2}$, $\mbox{S}_{8}$, Ar dan lain-lain; Dalam senyawanya, biloks logam golongan IA = +1, golongan IIA = +2, golongan IIIA = +3. Contoh: biloks Na dalam NaOH adalah +1 ( karena Na terletak pada golongan IA)

Cara Menentukan Bilangan Oksidasi (Biloks) Unsur Dalam Senyawa Ukuran Dan Satuan PDF
Unsur bebas memiliki biloks = 0. Unsur bebas adalah. Contoh Unsur bebas adalah: H 2, N 2, O 2, F 2, Cl 2,Br 2, I 2, P 4, S 8, Al, Fe. b. Biloks H dalam senyawanya pada umumnya = +1. Contoh: Biloks H dalam H 2 O adalah +1. Biloks H dalam NH 3 adalah +1. Kecuali dalam senyawa hidrida logam, biloks H = -1.

REAKSI REDOKS Reaksi Reduksi 1 Reaksi yang mengalami
Berikut aturan-aturan untuk menentukan biloks. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) Unsur bebas adalah unsur-unsur yang tidak stabil dan tidak berikatan kimia dengan unsur lain. Contohnya, Na, H 2, N 2, Br 2, Be, K, O 2, dan P 4. Kedelapan unsur tersebut memiliki bilangan oksidasi nol. 2. Bilangan oksidasi ion monoatomik sama dengan.
unsur bebas adalah
3. Diketahui senyawa HNO₃. Tentukan biloks unsur H. a. +1 b. +16 c. +26 d. +36 e. +46 Pembahasan Pembahasan Jawaban Biloks Unsur H= +1 (a). Soal nomor 4 4. Diketahui senyawa HNO₃. Tentukan biloks unsur N a. +5 b. +15 c. +25 d. +35 e. +45 Pembahasan Diketahui: bilangan oksidasi unsur O= -2 bilangan oksidasi unsur H= +1 Ditanya : biloks unsur.