
LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Buku Interaksi Alam Basa Dalam Kehidupan menulis, menurut sumber asalnya, asam dibedakan menjadi 2 yakni asam organik dan asam anorganik. - Asam organik Asam organik merupakan asam yang banyak terdapat pada bahan makanan yang disebut asam karboksilat, dengan kandungan ikatan C - H atau C - O. Asam ini juga kerap dipakai untuk campuran bahan kosmetik.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Sementara basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air serta senyawa ionic garam. Reaksi itu disebut reaksi netralisasi. Asam dan basa merupakan dua jenis larutan yang kerap digunakan dalam kehidupan sehari-hari manusia. Asam dan basa ada yang memiliki sifat kuat dan juga lemah.

Kimia Asam Dan Basa
Seng Hidroksida (Zn(OH) 2) Rumus asam basa. Rumus asam basa di bawah ini akan berguna saat pembuatan laporan praktikum titrasi asam basa. Sedikit informasi, titrasi asam basa adalah prosedur untuk menentukan kemolaran, kadar asam , atau basa berdasarkan netralisasi. Berikut ini adalah rumus asam basa yang sering digunakan dalam titrasi asam.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Pembahasan. Reaksi ionisasi adalah proses terurainya elektrolit menjadi pertikel-partikel bermuatan listrik (ion). Dalam ionisasi dikenal namanya kation (ion positif) dan anion (ion negatif). Reaksi ionisasi barium hidroksida adalah sebagai berikut: Dimana kationnya adalah dan anionnya . Jadi, reaksi ionisasinya adalah .

Pengertian Asam dan Basa Serta Penggunaannya
Barium hidroksida adalah senyawa kimia dengan rumus Ba(OH) 2 (H 2 O) x.Monohidratnya (x =1) dikenal dengan nama barit atau air barit. Pembuatan. Barium hidroksida dapat dibuat dengan melarutkan barium oksida (BaO) di dalam air: . BaO + 9 H 2 O → Ba(OH) 2 ·8H 2 O Reaksi. Barium hidroksida mengalami dekomposisi menjadi barium oksida saat dipanaskan hingga mencapai suhu 800 °C.

Asam dan Basa Konjugasi
Larutan asam dan basa dapat diperoleh dengan melarutkan asam atau basa secara langsung ke dalam air. Selain itu,. KOH, dan Ba(OH) 2. 2. Asam Lemah dan Basa Lemah. Asam lemah adalah senyawa asam yang sulit melepaskan ion H + dalam air dan mengalami disosiasi sebagian dalam larutannya. Contoh asam lemah yaitu H 3 PO 4, H 2 SO 3,.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Basa-Basa Kuat 2,Asam-Asam dan Basa-Basa Lemah 3,Hubungan Antara Tetapan Ionisasi Asam Dengan Basa Konjugasinya 4. Kesetimbangan yang mengikutsertakan Asam-Asam dan Basa-Basa Lemah 1.1. Asam - basa kuat 1.2.pH asam -basa kuat 2.1. Asam -basa lemah 2.2. pH asam - basa lemah 3.1 Asam dan basa konjugasi 3.2.Hubungan Ka dan Kb 4.1.

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
2 CH 3 COOH + Ba(OH) 2 → (CH 3 COO) 2 Ba + 2 H 2 O; Walaupun reaksi asam basa disebut reaksi penetralan, tetapi hasil reaksi itu (disini yang dimaksud adalah garam) tidak selalu bersifat netral, melainkan tergantung pada kekuatan asam basa yang membentuknya.. Untuk mengetahui apakah suatu reaksi menghasilkan endapan atau tidak, kita harus.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
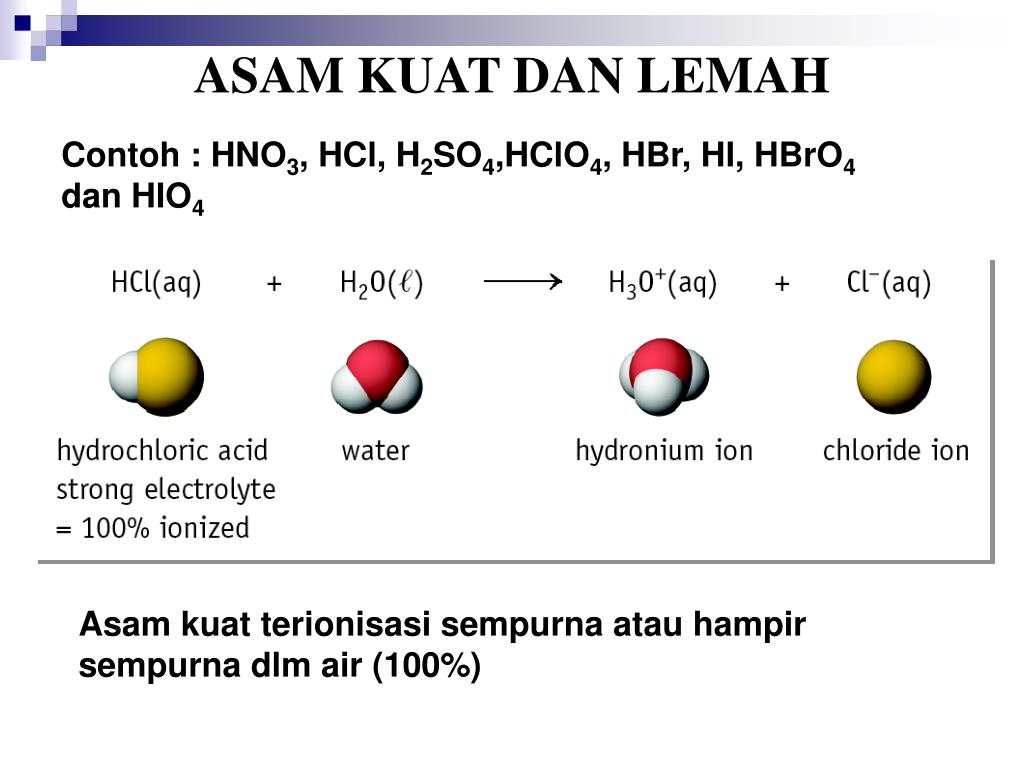
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Mg Oh 2 Basa Kuat Atau Lemah cara bertanya yang baik kepada guru
Sifat asam yaitu korosif, sedangkan sifat basa yaitu kaustik. Lebih jelasnya, simak penjelasan berikut ini berdasarkan teori asam basa Arrhenius. Seorang ahli kimia asal Swedia, Svante August Arrhenius (1859-1927) menjelaskan asam adalah suatu zat yang ketika dilarutkan dalam air akan terurai dan menghasilkan ion H+.
Asam basa
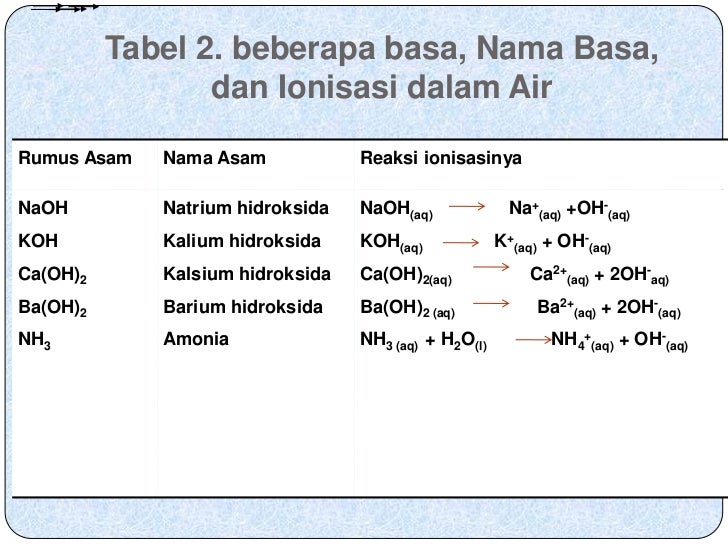
Contoh dari basa kuat seperti natrium hidroksida (NaOH), litium hidroksida (LiOH), kalium hidroksida (KOH), barium hidroksida (Ba(OH)2), dan kalsium hidroksida (Ca(OH)2). 2. Asam lemah dan basa lemah. Asam lemah adalah asam yang hanya terionisasi sebagian di dalam air sehingga nilai a-nya kecil.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Dari reaksi asam basa di atas, diketahui bahwa HCl merupakan asam kuat, sedangkan Ba(OH) 2 adalah basa kuat sehingga menghasilkan garam (BaCl 2) dan air yang netral, yaitu pH = 7. Selain itu, dari reaksi di atas juga bisa menghasilkan zat sisa berupa asam dengan pH di bawah 7 atau zat sisa berupa basa dengan pH di atas 7. 2. Reaksi antara asam.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID4714427
Ba(OH)2 dapat bereaksi dengan asam atau basa, membentuk garam dan air dalam reaksi netralisasi. Senyawa ini memiliki berbagai aplikasi dalam industri, termasuk pembuatan kertas, industri tekstil, keramik, produksi karet, dan pengobatan medis. Dengan memahami persamaan reaksi Ba(OH)2 dan penggunaannya, kita dapat mengaplikasikan senyawa ini.

PPT TEORI ASAM BASA PowerPoint Presentation, free download ID5368090
Basa sukar larut dalam air, kecuali: NH4OH, KOH, NaOH, Ba(OH)2, Sr(OH)2, Ca(OH)2. Umumnya basa berwarna putih; Efek basa pada kulit dan rambut. Kertas lakmus terbuat dari bahan kimia yang akan berubah warna jika dicelupkan kedalam larutan asam atau basa. Warna yang dihasilkan sangat dipengaruhi oleh kadar pH dalam larutan yang ada.

Teori Asam Basa
Dalam kasus ini, basa kuat (Ba(OH) 2) dinetralkan oleh asam hingga seluruh basa bereaksi. Hal ini memungkinkan pengamat untuk menghitung konsentrasi basa dari volume asam standar yang digunakan.. Asam atau basa monoprotik hanya mempunyai satu titik ekuivalen pada kurva titrasi. Kurva titrasi asam diprotik. Daerah berwarna merah muda yang.

Cara Menentukan Senyawa Bersifat Asam Basa Atau Netral Digunakan
Kalau pada suhu 25℃, pH < 7 bersifat asam, pH = 7 bersifat netral, dan pH > 7 bersifat basa. Derajat keasaman dan kebasaan suatu larutan. (dok. Flickr/boellstiftung) Semakin kecil nilainya, maka larutan tersebut akan semakin asam. Misalnya antara larutan dengan pH 3 dan 1, akan lebih kuat konsentrasi asam dengan pH 1 daripada 3.